Фторхинолоны занимают важное место в лечении больных туберкулезом, особенно в случаях с множественной и широкой лекарственной устойчивостью возбудителя [1]. Применение этой группы препаратов способствует сокращению сроков лечения и повышению эффективности терапии лекарственно-резистентных форм туберкулеза. Они являются мощными антибактериальными препаратами [2], обладающими бактерицидными свойствами в отношении М. tuberculosis, что доказано многочисленными экспериментальными исследованиями in vitro [3, 4]. Однако в последние годы все чаще встречаются публикации о быстром распространении штаммов микобактерий туберкулеза (МБТ) с первичной устойчивостью к фторхинолонам [5]. Мишенями действий фторхинолонов являются ферменты топоизомераза II и топоизомераза IV [6, 7]. Фторхинолоны вызывают разрыв нитей ДНК и гибель клетки. ДНК-гираза состоит из двух субъедииц gyrА и двух субъединиц gyrB (соответствующие гены gyrА и gyrB). Устойчивость к фторхинолонам связана, преимущественно, с мутациями гена gyrA [5, 7–9], который является структурным геном субъединицы гиразы А и содержит 5 полиморфных кодонов – позиции 88, 90, 91, 94 и 95. Учитывая регионально-географические особенности распространения мутаций в генах, обусловливающих резистентность к группе фторхинолонов, мы изучили спектр мутаций гена gyrA штаммов M. tuberculosis, циркулирующих на территории Саратовской области.
Цель настоящей работы – изучение спектра и распространенности мутаций в гене gyrA в штаммах M. tuberculosis, циркулирующих на территории Саратовской области, с помощью биологических микрочипов.
Материалы и методы
 Обследовано 69 больных активным туберкулезом легких, находившихся на стационарном лечении в Саратовском областном клиническом противотуберкулезном диспансере в 2010–2012 гг. Из них 63 (91,3%) человека – впервые выявленные больные и 6 (8,7%) человек с рецидивами заболевания. Среди больных было 48 (69,6%) мужчин и 21 (30,4%) женщина в возрасте от 18 до 70 лет. Клинические формы заболевания были представлены преимущественно инфильтративным и диссеминированным туберкулезом легких – 48 (69,6%) и 13 (18,8%) человек соответственно. Другие формы туберкулеза наблюдались в единичных случаях: казеозная пневмония – у 2 (2,9%) пациентов, фиброзно-кавернозный туберкулез легких – у 2 (2,9%), туберкулемы – у 4 (5,8%). Бактериовыделение выявлено у 36 (52,2%) больных, деструктивные изменения в легких – у 41 (59,4%). У всех пациентов, наряду с традиционными методами микробиологической диагностики туберкулеза, выявление микобактерий туберкулезного комплекса, определение их лекарственной устойчивости (ЛУ) к фторхинолонам, а также изучение спектра генетических мутаций ДНК M. tuberculosis проводили в образцах мокроты с помощью биологических микрочипов с использованием набора реагентов ТВ-БИОЧИП-2 (ООО «БИОЧИП-ИМБ», Москва). Результаты реакции учитывали с помощью аппаратно-программного комплекса «Чипдетектор-01» с соответствующим программным обеспечением ImageWare (Россия).
Обследовано 69 больных активным туберкулезом легких, находившихся на стационарном лечении в Саратовском областном клиническом противотуберкулезном диспансере в 2010–2012 гг. Из них 63 (91,3%) человека – впервые выявленные больные и 6 (8,7%) человек с рецидивами заболевания. Среди больных было 48 (69,6%) мужчин и 21 (30,4%) женщина в возрасте от 18 до 70 лет. Клинические формы заболевания были представлены преимущественно инфильтративным и диссеминированным туберкулезом легких – 48 (69,6%) и 13 (18,8%) человек соответственно. Другие формы туберкулеза наблюдались в единичных случаях: казеозная пневмония – у 2 (2,9%) пациентов, фиброзно-кавернозный туберкулез легких – у 2 (2,9%), туберкулемы – у 4 (5,8%). Бактериовыделение выявлено у 36 (52,2%) больных, деструктивные изменения в легких – у 41 (59,4%). У всех пациентов, наряду с традиционными методами микробиологической диагностики туберкулеза, выявление микобактерий туберкулезного комплекса, определение их лекарственной устойчивости (ЛУ) к фторхинолонам, а также изучение спектра генетических мутаций ДНК M. tuberculosis проводили в образцах мокроты с помощью биологических микрочипов с использованием набора реагентов ТВ-БИОЧИП-2 (ООО «БИОЧИП-ИМБ», Москва). Результаты реакции учитывали с помощью аппаратно-программного комплекса «Чипдетектор-01» с соответствующим программным обеспечением ImageWare (Россия).
Базовая методология проведения исследований основана на выделении ДНК МБТ из мокроты обследуемых пациентов, проведении мультиплексной двухстадийной ПЦР со специфическими для МБТ праймерами и последующей гибридизации продуктов амплификации 2-й стадии ПЦР с олигонуклеотидными зондами, помещенными в ячейках микрочипа [10].
Статистическую обработку результатов исследования осуществляли с помощью компьютерных программ Microsoft Excel® и STATISTICA 6. В качестве критического уровня достоверности был принят критерий 0,05.
Результаты и обсуждение
 В результате исследований ДНК микобактерий туберкулезного комплекса в количестве, достаточном для определения ЛУ, была выделена из мокроты у 60 (86,9%) из 69 пациентов с активным туберкулезом легких, в том числе у 35 (97,2%) из 36 пациентов с бактериовыделением и у 25 (75,8%) из 33 пациентов без бактериовыделения. Мутации в гене gyrA, кодирующие ЛУ к фторхинолонам, выявлены у 12 (20%) пациентов. Первичная ЛУ установлена у 10 (16,7%) человек и в 2 (3,3%) случаях выявлена вторичная ЛУ (на фоне приема пациентами 90–120 доз антибактериальных препаратов). Среди обследованных пациентов у 29 (48,3%) была обнаружена мутация в кодоне 95Ser (AGC)→Thr (ACC), приводящая к замене серина на треонин. Данный вид мутаций обусловлен естественным полиморфизмом гена и не приводит к ЛУ [7]. У 19 (31,7%) пациентов мутаций в гене gyrA не обнаружено. Результаты представлены на рисунке.
В результате исследований ДНК микобактерий туберкулезного комплекса в количестве, достаточном для определения ЛУ, была выделена из мокроты у 60 (86,9%) из 69 пациентов с активным туберкулезом легких, в том числе у 35 (97,2%) из 36 пациентов с бактериовыделением и у 25 (75,8%) из 33 пациентов без бактериовыделения. Мутации в гене gyrA, кодирующие ЛУ к фторхинолонам, выявлены у 12 (20%) пациентов. Первичная ЛУ установлена у 10 (16,7%) человек и в 2 (3,3%) случаях выявлена вторичная ЛУ (на фоне приема пациентами 90–120 доз антибактериальных препаратов). Среди обследованных пациентов у 29 (48,3%) была обнаружена мутация в кодоне 95Ser (AGC)→Thr (ACC), приводящая к замене серина на треонин. Данный вид мутаций обусловлен естественным полиморфизмом гена и не приводит к ЛУ [7]. У 19 (31,7%) пациентов мутаций в гене gyrA не обнаружено. Результаты представлены на рисунке.
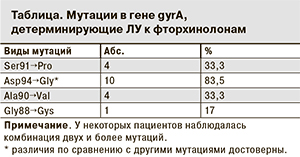
Спектр и распространенность мутаций в гене gyrA, кодирующих ЛУ к фторхинолонам, представлены в таблице.
Как следует из таблицы, из 12 фторхинолонрезистентных штаммов значительно чаще (84,5%) встречались мутации в кодоне 94, реже – в кодонах 90, 91, 88 (p < 0,05). По данным других исследователей [11], мутация в кодоне 94 наиболее часто встречается среди изолятов с широкой ЛУ микобактерий (XDR).
У некоторых пациентов наблюдалась комбинация двух и более мутаций. В 2 случаях нами установлены двойные мутации в гене gyrA: /Asp94→Gly + Ala90→Val/ и /Asp94→Ala + Ala90→Gly_a/. У 3 пациентов выявлена комбинация из 3 мутаций, из них у 1 – /Asp94→Gly + Ala90→Val + Gly88→Gys/ и у 2 человек – /Ser91→Pro + Ala90→Gly + Asp94→Ala/. У 1 пациента выявлена комбинация из четырех мутаций: /Ser91→Pro + Asp94→Gly + Ala90→Val a + Gla 88=Gys/. По данным литературы, появление одной мутации в гене gyrA не всегда приводит к полной резистентности МБТ ко всем антибактериальным препаратам фторхинолонвого ряда. Однако наличие двух и более мутаций гена приводит к развитию высокого уровня ЛУ к фторхинолонам [9] и сопряжено с полной потерей активности даже наиболее сильных фторхинолонов [12].
Таким образом, у пациентов, проживающих на территории Саратовской области, первичная ЛУ к фторхинолонам на уровне генетических мутаций регистрируется в 16,7% случаев, вторичная – в 3,3%. Из них в 50% изолятов наблюдается комбинация двух и более мутаций, что сопряжено с высоким уровнем ЛУ к фторхинолонам и требует разработки дополнительных мер, препятствующих дальнейшему распространению резистентности к фторхинолонам M. tuberculosis.


