Хронический гепатит С (ХГС) представляет одну из наиболее серьезных и актуальных проблем современного здравоохранения, поскольку характеризуется повсеместным распространением и частым формированием неблагоприятных исходов, связанных с развитием цирроза печени и гепатоцеллюлярной карциномы. Актуальность проблемы определяется и тем, что заболевание развивается чаще в молодом трудоспособном возрасте, что приносит огромный экономический ущерб государству.
Число инфицированных вирусом гепатита С позволяет отнести этот возбудитель к разряду глобальных пандемических агентов. В 70–90% случаев заболевание принимает хроническое течение, которое сопровождается прогрессирующим фиброзным перерождением печени с вероятным исходом в цирроз и/или рак печени. Ежегодно от цирроза печени вирусной этиологии умирают в мире более 1,5 млн человек [1].
Поскольку прогрессирование ХГС патогенетически тесно связано с началом фиброзных изменений в печени, своевременная диагностика стадий фиброза оказала бы огромную помощь специалистам при выработке тактики лечения больного и позволила бы своевременно скорректировать лечебные мероприятия по предупреждению угрожающих жизни больного состояний, к которым принадлежит и цирроз печени [2].
В настоящее время «золотым» стандартом определения степени фиброзных изменений печени является биопсия с последующим цитологическим определением стадии фиброза, однако этот метод относится к числу инвазивных, а его использование иногда приводит к серьезным осложнениям, что заставляет продолжать поиск неинвазивных критериев оценки стадии фиброза и цирроза [3, 4].
За последнее время предложен ряд неинвазивных методов оценки фиброза печени, в том числе основанных на определении в крови больных сывороточных маркеров печеночного фиброза, но их сравнительная диагностическая эффективность на отдельных стадиях фиброзного процесса больных ХГС к настоящему времени не уточнена.
К сывороточным маркерам оценки состояния печени относят прямые и непрямые тесты неинвазивной диагностики. К прямым биомаркерам фиброза принадлежат: гиалуроновая кислота (ГК), коллаген I и IV типа, проколлаген III типа, тканевые ингибиторы металлопротеиназ 1 и 2, металло-протеиназы 1 и 2. Определение этих показателей в крови имеет самостоятельное значение для диагностики стадии фиброза, кроме того, на их основе создан ряд тестов: MP3, ELF и др. [5]. Непрямые маркеры фиброза – это молекулы, высвобождаемые в кровь и в той или иной степени отражающие патологический процесс, происходящий в печени. В частности, это АЛТ и АСТ, аполипопротеин А1, альфа-2-макроглобулин (А2М), ферритин, гаптоглобин, холестерин и билирубин. На основе непрямых фибромаркеров в сочетании с показателями коагулограммы, гемограммы и демографическими данными больных разработаны тесты для диагностики фиброза: AAR, APRI, ASPRI, FIB- 4,FibroIndex, индекс Форнса, Fibrotest и др. [6]. Выделяют также комплексные фиброзные пане-ли, включающие прямые и непрямые биомаркеры: SHASTA, FIBRO Spect, тесты Zeng, Hepascore, Fibrometer и др. [7, 8].
Безусловно, наибольший интерес современных исследователей вызывает возможность неинвазивного определения степени фиброза печени с помощью рутинных сывороточных показателей, поскольку это не требует наличия дорогостоящего оборудования и может быть реализовано в любом амбулаторно-поликлиническом или стационарном учреждении.
Целью исследования послужила разработка критериев определения стадий фиброза печени в процессе мониторинга больных ХГС с использованием методов неинвазивной диагностики фиброза печени на основе рутинных лабораторных показателей. Исследование выполнено при финансовой поддержке Министерства образования и науки Российской Федерации (Государственный контракт № 11.519.11.2034 от 01.11.2011).
Для реализации поставленной цели анализировали сопоставительные значения прямых, непрямых и комбинированных неинвазивных тестов у 141 больного ХГС в возрасте от 18 до 60 лет, проходивших обследование на базе медицинской компании «Гепатолог» (Самара). Параметры для расчета неинвазивных индексов фиброза определяли с помощью рутинных методик, включая гематологический метод (определение числа тромбоцитов в крови), биохимический анализ крови [определение уровней билирубина, холестерина, мочевины, некоторых белковых фракций крови (альбумина, А2М, γ-глобулина), активности ферментных систем крови (АЛТ, АСТ, ГГТ, щелочной фосфатазы)], определение некоторых показателей свертываемости крови (протромбиновое время, протромбиновый индекс и международное нормализованное отношение). При определении некоторых индексов, характеризующих цирроз печени, использовали результаты определения диаметра селезенки в ходе УЗИ. Расчет чувствительности, специфичности и диагностической точности тестов производили с учетом рекомендаций D.G. Altman и J.M. Bland [9].
При выполнении этих исследований больные ХГС были разделены на 5 групп в соответствии с результатами гистологического изучения биоптатов печени и их последующей оценки по шкале METАVIR: 1-я (F0) – 14 человек, 2-я (F1) – 56 человек, 3-я (F2) – 19 человек, 4-я (F3) – 16 человек, 5-я (F4) – 36 человек. Анализ распределения больных по полу и возрасту в соответствии со стадиями фиброза печени показал, что между стадиями практически не регистрировались различия по полу, но проявлялись возрастные различия в виде преобладания в группе с циррозом печени (F4) лиц старше 45 лет (69,4%). Наиболее часто в крови больных ХГС в наших исследованиях был отмечен низкий уровень вирусной нагрузки, среди генотипов вируса гепатита С преобладал 1b (62%).
К прямым рутинным методам неинвазивной диагностики фиброза печени у больных ХГС было отнесено определение уровня ГК в сыворотке крови. Результаты (рис. 1) показали отсутствие достоверных отклонений данного показателя у больных на стадиях фиброза F0–F3 по сравнению с контрольной группой. В то же время развитие цирроза печени сопровождалось ростом содержания ГК в крови > 100 мкг/л при чувствительности теста 75%, специфичности 100%, диагностической точности 94%, что совпадало с данными литературы [10].
Далее определяли диагностическое значение ряда индексов непрямой неинвазивной диагностики стадий фиброза печени у больных ХГС.
Индекс AAR проявлял в наших исследованиях относительно невысокую информативность. Критерием его диагностического значения служит величина выше 1, которая свидетельствует в пользу цирроза печени (F4), а ниже 0,5 – говорит о его отсутствии [6, 11]. В наших исследованиях процент попадания индивидуальных значений индекса AAR в диапазон выше 1 для больных ХГС с подтвержденной гистологически стадией F4 (чувствительность теста) составлял только 56%, что не позволяет признать за этим тестом высокой диагностической значимости.

Диагностическое значение индекса APRI заключается в следующем: величины показателя выше 1 указывают на высокую вероятность выраженного фиброза печени (≥ F3), ниже 0,5 – на его отсутствие [6, 12]. На рис. 2 показано, что верхняя граница критерия, направленная на определение стадии ≥ F3, у больных ХГС регистрировалась в 86% случаев на стадии F3 и в 88% – на стадии F4. Значения индекса APRI ниже 0,5 отмечались только у больных со стадией F0 в 70% случаев. Таким образом, индекс APRI гораздо более информативен, чем AAR для выявления как отсутствия фиброза печени, так и наличия выраженного фиброза (≥ F3). Этот вывод подтверждает и расчет его чувствительности на стадиях F3–F4 (86%), специфичности (95–98%), диагностической точности (72–80%).
Индекс ASPRI предназначен для выявления цирроза печени. При значении показателя больше 12 диагностируется цирроз печени [13]. Наши исследования четко продемонстрировали, что критериальные значения ASPRI регистрируются на стадии F4 только у 56% пациентов с ХГС, т. е. не оправдывают своей диагностической значимости.
Диагностическая роль индекса FIB-4 связана с определением вероятности выраженного фиброза (≥ F3): при значении индекса > 1,45 его вероятность мала (порядка 90%), при значении < 3,25 – велика [14, 15]. В наших исследованиях низкая вероятность значительного фиброза в 100% случаев была установлена только на стадии F0 при диагностической точности теста всего 45%. На остальных стадиях фиброзного процесса диагностическая точность индекса FIB-4 колебалась в пределах 16–38%, т. е. была еще ниже.
Индекс Форнса (Forns) позволяет определять значимый фиброз печени (F2–F4) [6, 16, 17], которому соответствуют значения индекса > 4,2. Переход со стадии F1 (критерию соответствовали показатели 36% больных) на стадию F2 (удовлетворяли критерию данные 64% больных) регистрировали с помощью этого индекса не очень четко. Начиная со стадии F3, соответствие критериальному диапазону индекса Форнса наблюдалось в 100% случаев, т. е. чувствительность теста при регистрации выраженного фиброза была довольно высока, однако его специфичность находилась на довольно низком уровне (49–50%), как и диагностическая точность, которая составляла всего 55–61%.
Тест FibroIndex предназначен для прогнозирования значимого фиброза печени (F3–F4) у больных хроническими гепатитами. При значении индекса < 1,25 вероятность отсутствия фиброза составляет порядка 87%, при значении > 2,25 вероятность значимого фиброза составляет около 90% [6, 18]. В наших исследованиях отсутствие фиброза печени совпадало с критерием «< 1,25» в 56% случаев, но еще чаще (в 94% случаев) на стадии F1, т. е. данный критериальный диапазон себя не оправдывал. Диапазон «> 2,25» для стадий F3–F4 также был недостаточно информативным на стадии F3 (регистрировался только в 43% случаев), однако при циррозе печени попадание в этот диапазон значений сопровождалось чувствительностью на уровне 75%, специфичностью – 91%, диагностической точностью – 87%, т. е. было высоко информативным (рис. 3).
Тест MDA предназначен для выявления цирроза печени, при этом вероятность наличия цирроза высока, если значения индекса < 0 (диагностическая точность около 90%) [19]. В наших исследованиях (рис. 4) в группе больных с циррозом печени во всех случаях значения показателя были отрицательными. Подобный результат был зарегистрирован также у 25% больных ХГС на стадии F3 и ни разу на остальных стадиях фиброза печени (диагностическая точность 87%).
При оценке теста GUCI считают, что вероятность наличия цирроза печени мала при значениях индекса ниже 1 [20]. Наши исследования показали, что при значениях > 1 при чувствительности 86%, специфичности 95% и диагностической точности 71% можно констатировать наличие цирроза печени (см. рис. 4).
Что касается других тестов, используемых для регистрации цирроза печени – HALT-C (критерий > 50%), Bonacini (критерий ≥ 8), Testa (критерий ≤ 1750) [21], то их чувствительность не превышала 50–66% и значительно уступала таковой для MDA и GUCI.
Все комбинированные методы неинвазивной диагностики фиброза печени у больных ХГС, в частности Hepascore, Zeng и Fibrometer, при оценке их соответствия рекомендуемым в литературе диапазонам значений проявляли довольно высокую информативность.
Так, тест Hepascore (рис. 5) позволяет оценить степень выраженности фиброза при следующих значениях: ≥ 0,5 – определить наличие значимого фиброза (≥ F2); < 0,5 – исключить выраженный фиброз (≥ F3); ≥ 0,84 – предсказать цирроз (F4) [22, 23]. У обследованных больных с ХГС рекомендуемый для распознавания значимого фиброза (≥ F2) интервал встречался с частотой от 56 до 100% на соответствующих стадиях и гораздо реже на стадиях F0–F1. В последнем случае с частотой 56–80% регистрировались значения индекса < 0,5, что позволяло исключить фиброз ≥ F3. Значения ≥ 0,84, характерные для цирроза печени, отмечены нами в 75% случаев в данной группе больных ХГС и в единичных случаях – на других стадиях. В конечном итоге оказалось, что тест обладает достаточной диагностической точностью на стадии F0 при значениях < 0,5 (68%) и особенно на стадии F4 при значениях ≥ 0,84 (88%).
При интерпретации результатов теста Zeng (рис. 6) значения > 8,7 свидетельствуют о значимом фиброзе (≥ F2), а значения < 3 – об отсутствии или минимальном фиброзе [24]. Результаты применения этого теста у больных ХГС продемонстрировали значения > 8,7 в 67% случаев на стадии F3, в 75% случаев на стадии F4 и только в 11% случаев на стадии F2, но ни разу на других стадиях. Значения < 3, характерные для стадий F0–F1, наблюдались у 80% больных при отсутствии фиброза и только в 9% случаев на стадии начальных фиброзных изменений (F1). Результативность теста на стадии F0 при значениях < 3 была на уровне 83–94%, а на стадии F4 (> 8,7) – 75–92%.
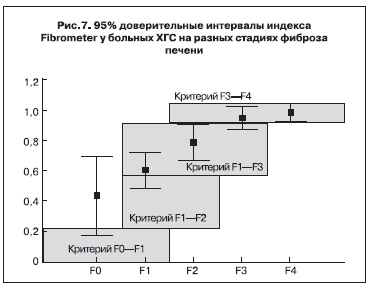 В тесте Fibrometer расчет производился по «базовой» формуле для оценки фиброза, доступной из открытых публикаций, без «отсеивания» значений маркеров и без учета этиологии заболевания. Интерпретация результатов была возможна двумя способами. В соответствии со способом 1 значения > 0,5 c вероятностью 80% соответствовали фиброзу F2 и выше, а < 0,5 – фиброзу меньше F2. Способ 2 предусматривал диагностику по 4 интервалам, показанным на рис. 7, которые с вероятностью 80–90% позволяли оценить степень фиброза [25, 26].
В тесте Fibrometer расчет производился по «базовой» формуле для оценки фиброза, доступной из открытых публикаций, без «отсеивания» значений маркеров и без учета этиологии заболевания. Интерпретация результатов была возможна двумя способами. В соответствии со способом 1 значения > 0,5 c вероятностью 80% соответствовали фиброзу F2 и выше, а < 0,5 – фиброзу меньше F2. Способ 2 предусматривал диагностику по 4 интервалам, показанным на рис. 7, которые с вероятностью 80–90% позволяли оценить степень фиброза [25, 26].
Из рис. 7 следует, что более высокая эффективность тестирования была отмечена при использовании способа 2 интерпретации результатов. Диапазоны значений, рекомендованные для распознавания стадий F0–F1 и F1–F2, у обследованных нами больных наблюдались довольно редко – всего в 20% случаев на стадии F0 и в 18% – на стадии F1 соответственно. Диапазон, характерный для стадий F1–F3, проявлял высокую (74–78%) степень соответствия на стадиях F1 и F2, но низкую – на стадии F3. Наконец, диапазон для стадий F2–F4 включал 89–100% больных ХГС на стадиях F3–F4 и только 22% больных на стадии F2. В результате при значениях теста 0,5–0,852 с чувствительностью 73–77%, специфичностью 74%, диагностической точностью 70% можно диагностировать стадии F1–F2, а при значениях 0,853–1,0 с диагностической эффективностью от 69 до 91% – стадии F3–F4.
Полный перечень диагностически значимых тестов у больных ХГС на каждой стадии фиброзного процесса представлен в таблице.
Выводы
- Различные методы неинвазивной диагностики на основе рутинных лабораторных показателей имеют особенности при оценке стадии фиброза печени у больных ХГС и могут быть рекомендованы как при первичном обследовании, так и в процессе мониторинга.
- Определение уровня ГК в сыворотке крови как прямого маркера фиброгенеза у больных ХГС относительно эффективнo в распознавании цирроза печени (F4).
- Среди непрямых методов неинвазивной диагностики фиброза печени наиболее высокой эффективностью обладают APRI на стадиях F3–F4, FibroIndex, MDA, GUCI – при циррозе печени.
- Среди комбинированных методов неинвазивной диагностики фиброза печени высокая эффективность отмечена у тестов Fibrometer на стадиях F1–F4, Hepascore и Zeng – на стадиях фиброзного процесса F0, F4.


