Крымская геморрагическая лихорадка (КГЛ) – зоонозная природно-очаговая инфекционная болезнь (код по МКБ-10 – А98.0), вызываемая вирусом Крымской-Конго геморрагической лихорадки (ККГЛ).
Вирусология и молекулярно-генетические аспекты эпидемиологии КГЛ
Вирус ККГЛ принадлежит роду Nairovirus семейства Bunyaviridae. Вирион ККГЛ – сферический, 90–100 нм в диаметре. Геном вируса ККГЛ представляет собой одноцепочечную РНК отрицательной полярности и состоит из 3 сегментов: малого S (кодирует нуклеокапсидный белок N), среднего M (кодирует белок-предшественник, впоследствии расщепляемый SKI-1 и S1P субтилазами и фурин-подобными протеазами на гликопротеины оболочки (Gn и Gc), неструктурный белок GP38 и муцино-подобный белок) и большого L (кодирует полипротеин, включающий РНК-зависимую РНК-полимеразу RdRp). Каждый сегмент имеет только одну транскрипционную единицу, окруженную нетранслируемыми 5’ и 3’ участками, которые необходимы для успешной транскрипции вирусной РНК, формирования вирусных частиц и репликации вируса в целом [1–4]. В конкретный момент времени с РНК вируса ККГЛ осуществляется либо транскрипция мРНК, либо репликация копии генома. Белок N не только участвует в упаковке сегментированной РНК, но и способствует распознаванию ее полимеразой RdRp. Гликопротеин G расщепляется в эндоплазматическом ретикулуме зараженной клетки, затем в виде гетеродимера Gn-Gc связывается с аппаратом Гольджи, в котором накапливаются также рибонуклеопротеиновые комплексы (РНП) [5]. РНП найровирусов производятся в трубкообразных «вирусных фабриках», состоящих из вирусных и клеточных компонентов и соединенных с эндоплазматическим ретикулумом, митохондриями и аппаратом Гольджи. Окончательная сборка вирионов осуществляется в аппарате Гольджи и завершается их экзоцитозом [2, 4].
На основании нуклеотидной последовательности S-сегмента выделяют несколько генотипов вируса ККГЛ: генотип I или «Африка-1», II или «Африка-2», III или «Африка-3», IVa или «Азия-1», IVb или «Азия-2», V или «Европа-1», VI или «Европа-2» (рис. 1). «Европа-1» является генотипом, ответственным за 99,9% случаев заболевания КГЛ в России, Турции и на Балканском полуострове, изоляты генотипа «Европа-2» обнаружены только у 3 больных и у 3 экземпляров клещей в Турции в 2007–2008 гг. и у клеща Rhipicephalus bursa в Греции в 1975 г. Генотип «Азия-1» является типичным для Ближнего Востока и юга Азии, генотип «Азия-2» распространен в Китае и среднеазиатских странах СНГ (см. рис. 1). Впрочем, генотип не жестко связан с географическим местом изоляции вируса: разные африканские генотипы выявляются в одном и том же регионе; в Иране и в 2010 г. в Испании выявлены штаммы, принадлежащие генотипу «Африка-1» [6]. Напротив, штаммы, принадлежащие генотипу «Азия-1», изолированы на Мадагаскаре. Генетические деревья, построенные на основании нуклеотидной последовательности L-сегмента, в целом подтверждают существование этих 7 генотипов. Однако анализ имеющихся в настоящее время последовательностей M-сегмента дает несколько иную классификацию. Штаммы «Европа-1» по-прежнему четко выделяются в одну группу (М4), в то время как изоляты генотипов «Африка-3» (типичного для ЮАР), «Азия-1» и часть изолятов «Азия-2» объединяются в группу М2, и напротив, генотип «Азия-2» разбивается на группы М2, М1 и М3 [7].
Характерно, что большинство несинонимичных, ведущих к изменениям аминокислотной последовательности мутаций сосредоточено именно в М-сегменте, особенно в так называемом О-гликозилированном муциноподобном вариабельном участке гликопротеина [8]. Предположительно, частота мутаций в этом участке в 2,3 раза выше, чем в консервативном участке М-сегмента [9]. Изоляты генотипа «Азия-2» наиболее гетерогенны с точки зрения наличия «значимых» аминокислотных замен в нуклеопротеине, то есть замен, меняющих заряд, гидрофобность и плотность упаковки участков аминокислотной последовательности [10]. В целом в популяции изученных штаммов вируса ККГЛ вариабельность по нуклеотидной последовательности для S-, M- и L-сегментов достигает соответственно 20, 31 и 22%; вариабельность по аминокислотной последовательности для этих сегментов составляет соответственно 8, 27 и 10% [11]. Частота мутаций для S-, M- и L-сегментов оценивается приблизительно в 1,1•10-4, 1,5•10-4 и 0,6•10-4 на нуклеотид в год соответственно. Исходя из этого, можно предположить, что общий предок известных генотипов вируса ККГЛ существовал 3000–3500 лет назад [12]. В другой работе [9] авторы дают близкие оценки: 0,3•10-4, 1,2•10-4 и 1,0•10-4 мутаций на нуклеотид в год для S-, M- и L-сегментов, но утверждают, что в генотипе «Африка-3» скорость мутаций выше. Для одноцепочечных вирусов с их несовершенными механизмами репарации вообще характерен активный мутационный процесс, однако у «комариных» арбовирусов обычно скорость мутаций выше, чем у клещевых. Например, у флавивируса Западного Нила скорость мутаций оценивается в 0,3–1,5•10-3 на нуклеотид в год [13].
Вероятно, генетическая однородность и географическая привязка генотипов вируса ККГЛ размываются в результате как миграции вируса (с инфицированными домашними животными или в клещах на перелетных птицах), так и наблюдающихся у найровирусов процессов реассортации и рекомбинации (при заражении одного и того же клеща несколькими штаммами вируса) [14]. При этом скорость рекомбинационных изменений невысока и уступает скорости мутационных изменений, но реассортационный обмен М-сегментом, кодирующим гликопротеины, отвечающие за антигенные свойства вируса и его связывание с клетками хозяина, может привести к возникновению штамма с измененной вирулентностью.
Секвенирование полной нуклеотидной последовательности S-сегмента нескольких штаммов вируса ККГЛ, выделенных в России в 1967 и 2000 гг., позволило отнести их к генотипу «Европа-1» [15]. Нами путем секвенирования короткого фрагмента (225 оснований) были охарактеризованы более 90 клинических изолятов вируса ККГЛ и изолятов от клещей Hyalomma marginatum, собранных в Ставропольском крае, Волгоградской, Астраханской и Ростовской областях c 2000 по 2011 г. [16]. Также были частично секвенированы штаммы из Крыма и Болгарии, предоставленные ФГБУ Институт полиомиелита и вирусных энцефалитов им. М.П. Чумакова РАМН. Последовательности сопоставлены с имеющимися в международной базе GenBank. Анализ подтвердил, что все изоляты вируса ККГЛ с юга России образуют четкую генетическую группу, отличную от штаммов из разных регионов Африки и Азии. Штаммы, изолированные на Балканском полуострове (Албания, Косово, Болгария) и в Турции, сходны с российскими.
В то же время среди южноевропейских изолятов можно выделить определенные топоварианты (см. рис. 1). Все волгоградские и часть ростовских изолятов объединяются в один кластер, а большинство астраханских, ставропольские и другая часть ростовских изолятов – в другой (верхняя ветвь на рис. 1). Выделяются также «балканская» группа и астраханская группа 2, максимально генетически удаленная от прочих.
Полученные данные и сформулированные на их основе методические подходы позволяют, с одной стороны, с помощью генетических методов следить за циркуляцией старых и возможной интродукцией новых штаммов вируса ККГЛ на юге России, с другой – поставить вопрос о возможных эпидемиологических и клинических отличиях КГЛ в России и Европе от эпидемиологических и клинических характеристик КГЛ в соседних среднеазиатских республиках, Китае, на Ближнем Востоке и в Африке.
Эпидемиология
Вирус ККГЛ был найден более чем в 30 видах клещей родов Hyalomma, Rhipicephalus, Dermacentor, Haemaphysalis, Boophilus, Ixodes, Amblyomma, Argas[1, 17, 18]. Однако это не означает, что все эти виды являются переносчиками вируса ККГЛ. Во-первых, в напитавшемся инфицированной кровью клеще и в его потомках (см. ниже) должна развиваться и поддерживаться достаточная виремия и, в первую очередь, высокая концентрация вируса ККГЛ в слюнных железах, чтобы клещ был способен заразить следующего позвоночного хозяина после присасывания («компетентность переносчика») [19]. Во-вторых, должен сложиться комплекс экологических условий (обилие клещей и чувствительных к вирусу ККГЛ позвоночных хозяев, в крови которых достигается необходимый для заражения уровень виремии; возможность их контакта; пищевые предпочтения членистоногих; благоприятные климатические условия и т.п.), позволяющий определенному виду клещей выступать в роли реального переносчика в природе. Показано, что переносчиками вируса ККГЛ являются многие виды иксодовых (Ixodidae) клещей рода Hyalomma. Напротив, аргасовые (Argasidae) клещи не являются компетентными переносчиками вируса ККГЛ [2, 17].
Поскольку иксодовые клещи питаются только один раз на каждой из стадий развития (личинка, нимфа, взрослая особь), инфицирование следующего позвоночного хозяина предполагает и требует трансстадийную передачу вируса ККГЛ [19]. При этом полный цикл развития большинства иксодовых клещей длится не менее двух лет, то есть они фактически могут выступать и в роли резервуарного хозяина – «хранителя» вируса ККГЛ в природных очагах, в том числе в зимний период [1, 2]. Показано, что клещи H. marginatum остаются инфицированными компетентными переносчиками вируса ККГЛ после года искусственной зимовки при температуре 4˚С [1, 17].
Кроме трансстадийной передачи для ряда видов клещей (H. marginatummarginatum, H. marginatumrufipes, H. truncatum, D. marginatus, Rh. rossicusи др.) выявлена и возможность трансовариальной передачи вируса ККГЛ (от инфицированной взрослой самки к яйцам) [1]. Более того, в эксперименте наблюдаются и «венерическое» заражение неинфицированных самок инфицированными самцами H. truncatum, и передача вируса ККГЛ от зараженного к незараженному клещу в процессе их одновременного питания на позвоночном хозяине (без развития у него заметной виремии). Все эти дополнительные механизмы могут потенциально усиливать эффективность и устойчивость циркуляции вируса ККГЛ в природе [2, 17].
Хозяевами и резервуаром вируса ККГЛ в природе являются зайцы, ежи, суслики, тушканчики, некоторые виды грызунов и копытных. Все они являются и прокормителями клещей рода Hyalomma: личинки и нимфы питаются, как правило, на мелких животных, взрослые особи – на копытных, включая домашний скот. Антитела к вирусу ККГЛ выявляются в сыворотках крови у коров, лошадей, коз, овец, верблюдов, ослов. Доля сероположительных проб варьирует в широких пределах: от 0,5 до 60% в зависимости от напряженности эпизоотической обстановки в очаге КГЛ. При экспериментальном заражении у этих животных развивается кратковременная виремия [1]. Птицы (например, грачи) также являются важными прокормителями иксодовых клещей, но ККГЛ-виремия у них, как правило, не развивается (за исключением страусов). Ни один из известных штаммов вируса ККГЛ не был изолирован от птиц в Евразии, тысячи исследованных на наличие антител к вирусу ККГЛ проб крови птиц были отрицательны [1, 2, 18].
В экспериментальных условиях кормление инфицированных клещей H. marginatum на неимунных кроликах-реципиентах приводит к развитию у них виремии. В свою очередь, после кормления неинфицированных личинок H. marginatum на кроликах и зайцах, в крови которых титр вируса ККГЛ превышал 2,5 lgЛД50/мл, вирус обнаруживался в выведшихся из личинок нимфах [1].
Возможны различные пути и источники заражения человека вирусом ККГЛ: присасывание клеща, контакт с содержащими вирус ККГЛ тканями раздавленного клеща, с кровью и другими тканями инфицированных животных или человека, а также лабораторное заражение. Относительная значимость этих путей в разных странах варьирует [20]. Упоминаются единичные случаи заражения вирусом ККГЛ при грудном вскармливании [21] и сексуальном контакте [22]. Недавно было показано, что РНК вируса ККГЛ выявляется также в слюне и моче больных КГЛ в количестве, сопоставимом с плазмой, однако возможность заражения при контакте с этими жидкостями нуждается в изучении [23].
В связи с этим к группам риска по заболеваемости КГЛ относятся животноводы, пастухи и другие сельскохозяйственные работники, мясники, медицинский персонал [1, 2, 24–27].
На основании характеристик эпидемического процесса при КГЛ российские специалисты считают возможным выделить несколько эпидемиологических типов заболеваемости: сельскохозяйственный, бытовой (приусадебный и жилищный), рекреационный (природный), промысловый (охотничий) и госпитальный [28].
Заболеваемость и региональные эпидемиологические особенности КГЛ
Ареал распространения вируса ККГЛ, по всей видимости, практически совпадает с ареалом распространения иксодовых клещей рода Hyalomma, охватывающим Африку и южную часть Евразии (приблизительно южнее 50˚ с. ш.). Более чем в 30 странах этого региона выявлена заболеваемость КГЛ или как минимум показано присутствие вируса ККГЛ в клещах. По условиям увлажненности это, чаще всего, зона, переходная между степью и пустыней; сумма эффективных температур варьирует от 3000 до 5000 ˚С и выше. На северной границе ареала длительность периода с температурой воздуха выше 10 ˚С составляет 150–160 дней, с температурой ниже 0 ˚С – около 120 дней; средние температуры зимой – не ниже -10 ˚С. Характерны фрагментация, мозаичность распределения очагов КГЛ, располагающихся обычно на территориях, непригодных для распашки и используемых для выпаса сельскохозяйственных животных [1].
Случаи заболевания КГЛ выявляются на Балканском полуострове с 1953 г. [29]. Крупнейшей считается вспышка 2001 г. в Косово (155 предполагаемых и 31 лабораторно подтвержденный случай, из них 7 летальных). До 16% клещей H. marginatum, собранных с крупного рогатого скота в этом регионе, были инфицированы вирусом ККГЛ. Впоследствии ежегодно диагностировали от 2 до 16 случаев КГЛ в Косово (всего с 2000 по 2009 г. 102 случая) и от 2 до 33 больных КГЛ в Албании (всего с 2000 по 2010 г. 61 случай) [30, 31].
В Болгарии с 1953 г. по 1974 г. ежегодно заболевало около 50 человек, после 2000 г. – около 15 (всего с 2000 г. по 2010 г. 161 больной). Летальность составляла в среднем 20%. Не исключено, что снижение заболеваемости могло быть связано с созданием, вслед за советскими специалистами, инактивированной мозговой вакцины против вируса ККГЛ и введением в 1975 г. вакцинации военнослужащих, работников здравоохранения и сельского хозяйства против КГЛ, а также с применением человеческого иммуноглобулина (внутримышечно, позже и реже – внутривенно) для профилактики КГЛ среди контактных лиц [1]. Однако в доступной литературе отсутствуют убедительные данные эпидемиологических и клинических наблюдений, свидетельствующие в пользу этого предположения [32]. Основным путем заражения было присасывание клеща, хотя наблюдались и нозокомиальные инфекции. Случаев заражения при забое инфицированных животных не было выявлено.
В Греции первый случай заболевания человека КГЛ был диагностирован только в 2008 г. Согласно исследованию, проведенному в 2008–2010 гг., доля здоровых доноров, имеющих IgG-антитела к вирусу ККГЛ, составляла в различных областях страны от 0 до 27% (в среднем 4,2%). Доля серопозитивных лиц была выше среди проживающих в северных и центральных областях страны, среди работников сельского хозяйства, особенно контактирующих с коровами и овцами. Серологические исследования сывороток крови людей и домашнего скота свидетельствовали о присутствии возбудителя на этой территории и ранее (в 1981–1988 гг.) [26, 30].
В Иране спорадические случаи и отдельные вспышки КГЛ регистрируются с 1999 г., преимущественно в апреле–сентябре в провинциях Систан и Балушистан (засушливый регион на юго-востоке страны), а также в центральной провинции Исфахан. В год лабораторно подтверждается более 50 случаев КГЛ (с 2000 по 2010 г. 738 случаев), при этом летальность составляет около 15% [33, 34]. Наиболее распространенный переносчик – H. detritum, однако основным фактором риска в Иране является не присасывание клеща, a контакт с кровью и тканями зараженных домашних животных, особенно у забойщиков скота и мясников [24]. В Пакистане наивысшая заболеваемость регистрируется на северной границе с Ираном в марте–мае и в августе–сентябре, нередки нозокомиальные вспышки КГЛ [30]. В Иране и Пакистане преимущественно выявляются штаммы генотипа «Азия-1» [35].
КГЛ регистрируется в западной части Китая (южный Синьцзян, Уйгурский автономный район на границе с Пакистаном, Афганистаном, Таджикистаном и Киргизией) с 1965 г. В ХХI веке официально диагностировано только несколько десятков случаев КГЛ, но реальная заболеваемость должна быть высока, поскольку до 30% взрослых, проживающих в эндемичном регионе Синьцзяна, имеют в крови IgG-антитела к вирусу ККГЛ, а инфицированность переносчиков – клещей H. asiaticumasiaticumи H. asiaticumkozlovi– достигает 0,5–5% [36]. Более того, область, у населения которой в пробах крови выявляются антитела к вирусу ККГЛ, простирается далеко на юго-восток, охватывая Внутреннюю Монголию и провинции Цинхай, Хайнань, Сычуань, Юньнань, Аньхой [37]. В частности в провинции Юньнань, граничащей с Мьянмой и Лаосом и покрытой тропическими лесами, доля серопозитивных лиц среди сельского населения старше 30 лет достигает 4,5%, а зараженность клещей H. asiaticum, собранных с крупного и мелкого рогатого скота, – 0,5% (по данным ПЦР) [27]. Китайские изоляты вируса ККГЛ принадлежат генотипу «Азия-2», как и штаммы из Узбекистана, Таджикистана, Казахстана [36, 38]. Исследования, проведенные в среднеазиатских республиках во времена СССР, выявили эпидемическое значение клещей H. asiaticum (преимущественно в Туркменистане и Казахстане), H. anatolicum (в Таджикистане и Туркменистане) и H. detritum (в Казахстане) [1, 18, 39]. Заболевания, клинически схожие с КГЛ, известны в этом регионе со средних веков. Первые лабораторно подтвержденные случаи заболевания КГЛ были выявлены в 1967 г. Подробнее эпидемиологические и клинические особенности КГЛ в Центральной Азии в ХХ веке описаны С.Е. Смирновой [1]. Сведения о заболеваемости в этих республиках в ХХI веке весьма неполны, но имеются сообщения о десятках случаев КГЛ, в том числе о нозокомиальных вспышках в Казахстане и Таджикистане в 2009 г. [31, 38, 40].
Кроме вышеперечисленных случаев, заболеваемость КГЛ или, как минимум, присутствие вируса ККГЛ отмечено в Афганистане, Ираке, Индии, ОАЕ, Кувейте, Киргизии, Туркменистане, Украине, Азербайджане, Армении, Грузии, Франции, Португалии, Испании.
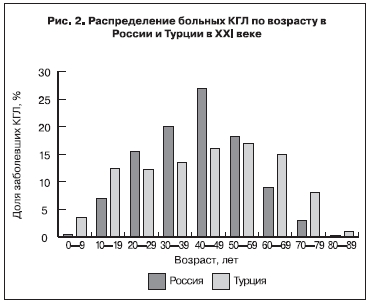
Наиболее драматично в ХХI веке развивалась эпидемическая ситуация по КГЛ в Турции. Хотя нейтрализующие антитела к вирусу ККГЛ выявлялись среди населения этой страны еще в 70-е годы, до 2002 г. клинических случаев КГЛ зарегистрировано не было. С 2002 г. заболеваемость КГЛ неуклонно и быстро нарастает (см. таблицу), преимущественно в долинах между Центральным Анатолийским плато и горами на северном побережье Турции, где до 13% лиц из групп риска (работники сельского хозяйства старше 40 лет) являлись IgG-серопозитивными к вирусу ККГЛ [30]. Среди больных КГЛ с 2004 по 2007 г. было приблизительно равное число мужчин и женщин, в эпидемический процесс были вовлечены все возрастные группы, за исключением детей моложе 10 лет и пожилых лиц старше 80 лет (рис. 2). Заболевания регистрировались с марта по октябрь, 77% случаев КГЛ пришлись на июнь–июль. 90% больных жили в селах или небольших городах, около 75% были заняты на сельскохозяйственных работах, в том числе 60% ухаживали за домашними животными. До 70% больных КГЛ имели в анамнезе присасывание клеща или контакт с клещами, 10% отмечали контакт с кровью или тканями животных. В 2004–2007 гг. было выявлено всего 3 случая нозокомиальной инфекции (0,2% от общего числа больных КГЛ) у медицинских работников [21].
Превалирующим видом клещей является H. marginatum (от 20 до 60% клещей, собираемых в различных условиях), уровень их инфицированности составляет 1–3% [41]. На азиатской части Турции циркулируют 2 генотипа вируса ККГЛ – «Европа-1» и «Европа-2». В последние годы было показано, что и на европейской части присутствуют оба генотипа вируса ККГЛ, регистрируются спорадические клинические случаи заболевания КГЛ, доля IgG-серопозитивных варьирует от 4 до 25%, а зараженность клещей H. marginatum и Rh. bursa составляет около 1–1,5% [25].
Заболеваемость КГЛ на территории СССР в ХХ веке была подробно описана ранее [18, 28, 42]. В ХХI веке заболеваемость КГЛ регистрировалась в 7 субъектах юга Российской Федерации (рис. 3). По данным официальной отчетности, собранным и проанализированным в Референс-центре по мониторингу за возбудителем КГЛ, больше всего случаев КГЛ выявлено в Ставропольском крае. Однако заболеваемость на 100 тыс. населения устойчиво и существенно выше в Республике Калмыкия (см. таблицу).
* 1953–1999 гг.; ** 1963–1970 гг.; *** 1955–1999 гг.; 4* – заносные случаи (из Ставропольского края); 5* 2003–2011 гг.
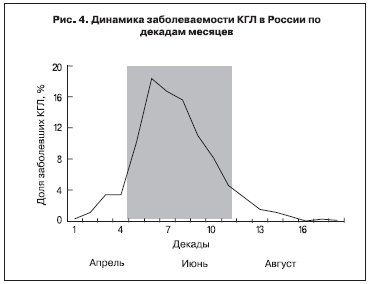
Заболеваемость КГЛ регистрируется с 1-й декады апреля по 1-ю декаду октября включительно, 80% случаев КГЛ имели место со 2-й декады мая по 1-ю декаду июля (рис. 4). В отличие от Турции, в Российской Федерации среди больных преобладали мужчины (66%). Возрастное распределение имело выраженный максимум в диапазоне от 40 до 49 лет, доля лиц трудоспособного возраста (20–60 лет) составила 81%, средний возраст больных – 43 года (см. рис. 2). 90% больных были жителями сельской местности, деятельность которых так или иначе связана с животноводством, полевыми работами или работами на личных подворьях. Формально лица, занятые в сельскохозяйственном секторе, составили 37%, неработающие – 35%, пенсионеры – 12%. 60% больных сообщили о присасывании клеща, 11% – о его снятии и раздавливании, 5% упомянули «наползание» клеща. (Ранее высказывалось предположение, что как «наползание» трактуется прерывистое питание самцов H. marginatum, меняющих место прикрепления [1]). В 24% случаев путь передачи инфекции не был установлен [43, 44]. Примечательно, что от 6 до 12% больных отрицают контакт с клещом и пребывание в природных биотопах и не могут предположить источник инфекции [43].
Анализ территориального распределения больных КГЛ в Российской Федерации в ХХI веке свидетельствует о последовательном значительном расширении нозоареала КГЛ. Эпидемически активная территория природного очага КГЛ, расположенного на юге Европейской части России, к настоящему времени занимает площадь около 290,8 тыс. км2, что составляет 49,4% территории ЮФО и СКФО, и охватывает всю территорию Астраханской области, 25 административных районов Ставропольского края, 10 районов Волгоградской области, 24 района Ростовской области, 11 районов Республики Калмыкия, 11 районов Республики Дагестан и 2 района Республики Ингушетия (см. рис. 3) [45]. Вероятно, это связано с соответствующим расширением ареала распространения иксодовых клещей, причем роль того или иного вида клещей может отличаться в разных регионах.
H. marginatum преобладает в ежегодных сборах в Астраханской области. При индивидуальном исследовании слюнных желез клещей установлена их спонтанная инфицированность вирусом ККГЛ, то есть возможность передачи вируса млекопитающим. Вирус ККГЛ был выявлен также у голодных имаго H. marginatum и в яйцекладках клещей этого вида, что указывает на наличие как трансстадийной, так и трансовариальной передачи вируса [1, 46].
Среди клещей, собранных в Ставропольском крае с 2001 по 2004 г., также преобладал вид H. marginatum. Среди пулов, содержащих антиген вируса ККГЛ, клещи H. marginatum составляли в разные годы от 80 до 100%. Минимальный уровень инфицированности (Minimal Infection Rate, MIR) имаго и нимф был от 2 до 8 вирусофорных клещей на 1000, уровень инфицированности личинок – более чем на порядок ниже. Были также обнаружены антигенположительные пулы клещей видов Hyalomma scupense, H. anatolicum, Dermacentormarginatus, Rhipicephalusrossicus, Ixodesricinus, что свидетельствует об интенсивности эпизоотического процесса в природном очаге КГЛ [47]. Поскольку такие находки были единичными и исключительно в напитавшихся имаго, роль этих видов клещей в циркуляции вируса ККГЛ нуждается в дальнейшем изучении.
Особенностью фауны членистоногих в Волгоградской области является широкое представительство клещей видов H. scupense, D. marginatusи D. reticulatus. Клещи вида H. marginatumвыявлялись в 1999 г. только в юго-западных районах (Котельниковском и Октябрьском), к 2006 г. они существенно продвинулись на север и заселили 10 районов области. Среди вирусофорных клещей преобладали H. marginatum, собранные в юго-западных районах области, где и были зарегистрированы более 75% клинических случаев КГЛ [48].
В Ростовской области в сборах с крупного рогатого скота приблизительно в равных долях присутствуют H. marginatum и D. marginatus, в сборах в открытых стациях доминирует D. marginatus. При этом среди зараженных вирусом ККГЛ клещей преобладает вид H. marginatum (70–90%), ареал которого с 2000 по 2008 г. расширялся на север, вплоть до 50˚ с. ш., равно как и зона, охваченная заболеваемостью КГЛ [49].
В Республике Ингушетия с 2004 по 2008 г. было диагностировано 6 случаев заболевания КГЛ, из которых 5 закончились летальным исходом. Выявление IgG-антител к вирусу ККГЛ в крови здоровых доноров (3%), крупного (4%) и мелкого рогатого скота (13%) позволило отнести предгорные степи Северного Кавказа к ареалу распространения КГЛ. В сборах с 2005 по 2008 г. преобладали клещи вида Boophilus annulatus, в меньшей степени присутствовали D. marginatum, D. reticulatus, Rh. rossicus. 70% вирусофорных проб состояли из пивших имаго B. annulatus [50, 51]. Поскольку клещи данного вида не питаются на человеке, можно предположить, что основными путями заражения были раздавливание клещей и, в нескольких случаях, прямой контакт с больными КГЛ. Примечательно, что обилие клещей Boophilus annulatus и их зараженность вирусом ККГЛ выявляли в 70-е годы в соседнем Азербайджане [1].
В 2005 г. впервые за последние 57 лет случай заболевания КГЛ был лабораторно подтвержден в Краснодарском крае [52].
Многие специалисты связывают активизацию старых и появление новых природных очагов КГЛ в Европе с потеплением климата, наиболее ярко проявившимся с 1998 по 2011 г. [21, 29, 39, 43, 53]. Поскольку продолжительность отдельных стадий и полного цикла развития H. marginatum температурно-зависима и в среднем требует температур выше 14˚С, это предположение представляется логичным [54]. Однако следует заметить, что связь заболеваемости с погодными условиями и климатом наиболее четко прослеживается в случае «комариных» трансмиссивных инфекций [55]. В случае клещевых инфекций не меньшую роль могут играть социально-экономические факторы и рост численности прокормителей клещей [53, 56].
Профилактика КГЛ
Зарубежный опыт целенаправленной профилактики КГЛ минимален [2]. В экономически развитых странах заболеваемость КГЛ отсутствует или низка, поэтому проблема профилактики не актуальна. В странах с невысоким национальным доходом, на территории которых находится большинство природных очагов КГЛ в Евразии и Африке, акарицидная обработка окружающей среды или домашних животных для профилактики КГЛ считается недостаточно экономически и эпидемиологически эффективной [32]. Определенные надежды возлагаются на разрабатываемые «антиклещевые вакцины», угнетающие питание самок клещей на привитых млекопитающих и последующую кладку яиц [57]. Подобные вакцины уже десятилетие используются для борьбы с паразитирующими на крупном рогатом скоте клещами рода Boophilus. В экспериментальных условиях «антиклещевая вакцина» способна также защитить животное от заражения арбовирусами, например, вирусом клещевого энцефалита, и тем самым прервать эпидемическую цепочку [58]. Упоминается, что лица из групп риска, проживающие в эндемичных по КГЛ регионах, должны быть обучены правилам пользования индивидуальными мерами защиты, но не приводятся свидетельства об особенностях и эффективности подобного обучения [30, 34].
Многие авторы обращают внимание на необходимость защиты медицинского персонала, среди которого в странах Евразии с 1976 по 2005 г. было выявлено не менее 30 случаев КГЛ. В развивающихся странах заболевают от 1 до 25% работников здравоохранения, контактирующих с больными КГЛ в ходе оказания медицинской помощи [1, 59]. Поскольку аспирационный механизм передачи КГЛ не документирован, утверждается, что достаточно стандартных мер, предотвращающих прямой контакт с кровью и тканевыми жидкостями больного [2]. Такие меры должны предусматривать защиту конъюнктивы и слизистых (защитные очки или экран, маска), поскольку возможно заражение при попадании брызг кровавой рвоты, капель крови, возможно, слюны при кашле и т.п. [22].
В России также наблюдались случаи внутрибольничного инфицирования медицинских работников, имевших непосредственный контакт с кровью или выделениями больных КГЛ в период геморрагических проявлений. Обращает на себя внимание тот факт, что в Ставропольском крае в 1999–2002 гг. на 133 заболевания КГЛ пришлось 6 (4,5%) случаев внутрибольничного инфицирования, а в 2003–2009 гг. на 359 больных – всего 2 (0,6%) случая [60]. Таким образом, ранняя клиническая и лабораторная диагностика КГЛ, надлежащее соблюдение медицинским персоналом требований противоэпидемического режима позволяют избежать внутрибольничного заражения. С другой стороны, нарушение санитарно-эпидемиологических правил в ЦРБ Сальского района Ростовской области привело в 2011 г. к возникновению внутрибольничного очага КГЛ (4 врача, 3 медицинские сестры, санитарка).
В Российской Федерации профилактике КГЛ уделяется существенно большее внимание [61]. Планирование и проведение профилактических мероприятий основывается на эпизоотологическом и эпидемиологическом районировании территории природного очага КГЛ. При районировании учитываются: природно-климатическая характеристика очага, видовой состав и численность мелких млекопитающих и птиц, места их обитания, видовой состав иксодовых клещей, их стациальное размещение и численность, результаты исследования клещей на вирусоносительство, а также индексы обилия и встречаемости клещей на крупном и мелком рогатом скоте, птицах и мелких млекопитающих. К «реально опасным» относятся участки природного очага, где установлена циркуляция вируса и к началу эпидемического сезона индекс обилия имаго H. marginatum составляет 3 и более экземпляров на одну голову крупного рогатого скота. При эпидемиологическом районировании природного очага КГЛ принимаются во внимание род занятий и хозяйственной деятельности населения, численность постоянного и временного населения, наличие и мощность лечебных и санитарно-профилактических учреждений, их укомплектованность специалистами, места инфицирования человека, преобладающие пути передачи инфекции, условия и причины, способствующие заражению человека, сезон инфицирования, характер эпидемических проявлений инфекции в прошлом. Сочетание эпизоотологических и эпидемиологических факторов риска определяет неблагополучные по КГЛ районы и время проведения интенсивных профилактических мероприятий [54, 56].
Борьба с переносчиками предусматривает меры экологического, хозяйственного и химического воздействия на популяцию клещей на всех стадиях развития с целью снижения численности популяции H. marginatum ниже порога эпидемической опасности (средний индекс обилия клещей на животных не должен превышать двух особей). В создании неблагоприятных условий для обитания иксодовых клещей важным моментом является трансформация естественных или несельскохозяйственных угодий в пашни, культурные сенокосы и пастбища посредством комплекса агротехнических мероприятий, проводимых в феврале–апреле. Акарицидным обработкам предшествует энтомологическое обследование природных биотопов (пастбищ). Для обработок пастбищ рекомендованы ранневесенний период со второй половины марта по апрель в зависимости от климатических условий (до начала выпаса поголовья сельскохозяйственных животных, но после активизации иксодовых клещей) и весенне-летний период (май–июнь). Барьерные обработки по периметру зон отдыха, детских лагерей и т.п. проводятся с мая по июль, но не чаще трех раз за сезон. Полевые испытания показали, что снижение численности клещей при минимальном влиянии на экологическую обстановку обеспечивают синтетические пиретроиды и фентион. Ветеринарной службой проводится уничтожение клещей на сельскохозяйственных животных – крупном и мелком рогатом скоте, лошадях, домашней птице. Разорение колоний врановых (грачи, вороны и др.), расположенных в непосредственной близости от населенных пунктов, уменьшает число прокормителей личинок и нимф и тем самым способствует снижению численности имаго в эпидемический сезон следующего года [54, 56, 62].
Систематические энтомологические обследования позволяют дать краткосрочный и среднесрочный прогноз развития эпидемической ситуации по КГЛ, являющийся основой планирования профилактических мероприятий. С этой целью уже в 2000 г. на территории Ставропольского края были организованы стационарные участки наблюдения в различных ландшафтных зонах: полупустынях, сухих степях, лесостепях. Мониторинг осуществлялся специалистами ФКУЗ Ставропольский научно-исследовательский противочумный институт Роспотребнадзора ежемесячно. В конце марта уточнялись начало выхода первых имаго Н. marginatum из зимней диапаузы и их численность. В апреле–мае осуществляли сбор имаго клещей и оценку их зараженности вирусом ККГЛ. Третье обследование выполняли в конце июня – начале июля, при этом проводили выявление и учет количества личинок и нимф на врановых. Заключительный выезд зоопаразитологических бригад для обследования участка природного очага КГЛ осуществляли в конце августа или в начале сентября в зависимости от погодных условий. Проводили учет числа пивших нимф и голодных имаго, уходящих в зимнюю диапаузу.
Исследования показали, что коэффициент смертности нимф иксодовых клещей в зимний период (отношение индекса обилия нимф H. marginatum к индексу обилия имаго H. marginatum в следующем календарном году) является достаточно стабильной величиной, зависящей от климатических условий, и может быть использован для среднесрочного прогноза численности имаго. Для районов центральной части Ставропольского края коэффициент можно принять равным 11, для северо-восточных районов – 22. Ошибка прогноза в 2001–2008 гг. при этом составила для центральных районов края от -8 до 13% (по абсолютной величине в среднем 6%), для северо-восточных районов от -18 до 7% (по абсолютной величине также 6%). Исключением явилась аномально холодная зима 2002–2003 гг., когда коэффициент смертности нимф превысил ожидаемый в 4 раза в центральных районах и в 2 раза в северо-восточных районах.
Другой стороной профилактики являются общемедицинские мероприятия, включающие информационно-разъяснительную работу среди населения, особенно среди групп риска, таких как владельцы скота; пропаганду средств и методов индивидуальной защиты от нападения иксодовых клещей в природных биотопах; обеспечение готовности лабораторной службы и общей медицинской сети к своевременному выявлению и лечению больных; специальную подготовку медицинских и ветеринарных работников на энзоотичной по КГЛ территории. Одним из показателей эффективности гигиенического обучения населения является количество лиц, обратившихся в лечебно-профилактические учреждения по поводу укуса клещами. С 2003 по 2011 г. их число превышало число больных КГЛ в 100–250 раз, что свидетельствует о достаточно высокой степени информированности и настороженности населения. Число провизорно госпитализированных превышало число больных КГЛ в 3–6 раз.
В целом для российского здравоохранения характерен комплексный подход к профилактике природно-очаговых инфекций, включая КГЛ, предусматривающий объединение и координацию усилий заинтересованных служб и ведомств Министерства здравоохранения и социального развития, Министерства сельского хозяйства, органов исполнительной власти в субъектах федерации в рамках программ, основанных на фундаментальных научных исследованиях и повседневном эпидемиологическом надзоре. В настоящий момент трудно судить, насколько удалось переломить тенденцию к росту заболеваемости КГЛ, отмечавшуюся с 2000 по 2008 г. не только в Российской Федерации, но и в Турции и балканских странах. Однако накопленный за эти годы опыт, разработанные и зарегистрированные диагностические препараты, принятые нормативные документы должны послужить борьбе с этим инфекционным заболеванием.


