Бруцеллез остается одной из наиболее актуальных опасных инфекций в регионах с развитым животноводством. Исключительный полиморфизм симптомов, многообразие форм болезни, частое развитие органных поражений при хроническом бруцеллезе, приводящих к инвалидизации лиц трудоспособного возраста, недостаточная эффективность существующих методов диагностики, профилактики и лечения этого заболевания определяют актуальность данной инфекционной патологии [1, 2].
Основой специфической профилактики бруцеллеза является вакцинация. Согласно санитарно-эпидемиологическим правилам СП 3.1.7.2613-10 «Профилактика бруцеллеза» [3], профилактические прививки против этого заболевания входят в национальный календарь прививок по эпидемическим показаниям. Вакцинация проводится в очагах козье-овечьего типа лицам, достигшим 18 лет и выполняющим работы по заготовке, хранению, обработке сырья и продуктов животноводства, полученных из хозяйств, где регистрируются заболевания скота бруцеллезом; по убою скота, больного бруцеллезом; животноводам, ветеринарным работникам, зоотехникам в хозяйствах, энзоотичных по бруцеллезу; работникам бактериологических лабораторий, работающим с живыми культурами.
Для иммунизации людей против бруцеллеза применяется вакцина, приготовленная из вакцинного штамма B. abortus 19 ВА, которая способствует сохранению напряженного иммунитета в течение 5–6 месяцев; ревакцинация групп риска осуществляется через 10–12 месяцев. Вакцинации подлежат лица с четкими отрицательными серологическими и аллергическими реакциями на бруцеллез [3].
 В соответствии с методическими указаниями МУ 3.1.7.1189-03 «Профилактика и лабораторная диагностика бруцеллеза людей», для оценки напряженности противобруцеллезного иммунитета в настоящее время используются реакции, основанные на выявлении специфических антител (РПГА, ИФА) [4]. Однако ряд исследователей [5–7] указывают на ведущую роль в защите организма от бруцелл клеточного звена иммунитета, соответственно серологические методы только косвенно могут указывать на напряженность противобруцеллезного иммунитета.
В соответствии с методическими указаниями МУ 3.1.7.1189-03 «Профилактика и лабораторная диагностика бруцеллеза людей», для оценки напряженности противобруцеллезного иммунитета в настоящее время используются реакции, основанные на выявлении специфических антител (РПГА, ИФА) [4]. Однако ряд исследователей [5–7] указывают на ведущую роль в защите организма от бруцелл клеточного звена иммунитета, соответственно серологические методы только косвенно могут указывать на напряженность противобруцеллезного иммунитета.
Согласно нормативной документации [4], повышенную чувствительность организма человека к бруцеллам выявляют с помощью кожно-аллергической пробы с бруцеллином (проба Бюрне) и реакции лейкоцитолиза (РЛ).
Постановка пробы Бюрне имеет ряд недостатков. У лиц, высоко сенсибилизированных к бруцеллезному антигену, возможно развитие реакции в виде повышения температуры, озноба, головной боли, лимфангита, артралгии и т. д. К недостаткам можно отнести риск возникновения ложноположительного результата при наличии в анамнезе аллергии. Учет реакции осуществляется через 48–72 ч [4]. Имеются сведения о низкой чувствительности и слабой специфичности РЛ при выявлении сенсибилизации к возбудителям инфекции [8]. Это, вероятно, связано с тем, что доминирующие механизмы развития инфекционной аллергии обусловлены Т-клеточным звеном иммунитета, а в РЛ осуществляется недифференцированный подсчет лейкоцитов.
Учитывая, что эпидемиологическая эффективность вакцинации против бруцеллеза зависит от правильного определения показаний к ее проведению, полноты отбора подлежащих иммунизации профессиональных групп, в том числе временного персонала, а также от объективности подходов к анализу результатов специфической профилактики, необходима модернизация методов оценки уровня сенсибилизации и напряженности иммунитета у лиц, подлежащих вакцинации и ревакцинации.
В последние годы повышенная чувствительность к антигену и напряженность поствакцинального иммунитета все чаще оценивается in vitro с использованием технологий проточно-цитометрического анализа клеток [5, 6, 9, 10].
В многочисленных исследованиях отечественных и зарубежных авторов [11–16] продемонстрирована высокая эффективность применения методов антигенной активации лейкоцитов in vitro для выявления сенсибилизации и уровня специфической невосприимчивости организма к патогенам.
Учитывая вышеизложенное, весьма актуальными и востребованными являются разработка и внедрение в практику принципиально новых подходов к оценке in vitro напряженности клеточного иммунитета и повышенной чувствительности (аллергизации) организма к возбудителю бруцеллеза.
Цель работы – разработка нового подхода к оценке степени аллергизации и напряженности иммунитета у лиц, подлежащих вакцинации против бруцеллеза.
Материалы и методы
Обследовали 67 человек, из них 24 первично вакцинированых против бруцеллеза – на 30-е сутки после иммунизации и 27 – через 12 месяцев после вакцинации. Контрольную группу составили 16 человек, не имевших в анамнезе симптомов аллергии, не больных и не переболевших бруцеллезом и не вакцинированных против этой инфекции.
Наличие и интенсивность аллергической реакции к возбудителю бруцеллеза определяли по экспрессии базофилами маркера активации CD63+, используя набор Flow-CAST® («Buhlmann laboratories», Швейцария) [6]. Напряженность клеточного иммунитета к возбудителю бруцеллеза выявляли с помощью реакции бластной трансформации лимфоцитов (РБТЛ) [7] с модернизированным нами способом учета результатов реакции, заключающейся в детекции бластных форм лимфоцитов моноклональными антителами к маркеру гемопоэтических бластных клеток CD34+ («Beckman Coulter», США) с последующим проточно-цитометрическим анализом образца. В качестве специфического антигена бруцелл использовали бруцеллин (НПО «Микроген», Россия). Цитометрический анализ был проведен с помощью проточного цитофлуориметра FACS Calibur («Beckton Dickinson», США).
 Обеззараживание исследуемого материала осуществляли в соответствии с санитарно-эпидемиологическими правилами СП 1.3.3118-13 «Безопасность работы с микроорганизмами I–II групп патогенности (опасности)» [17] путем добавления к исследуемой пробе мертиолята натрия до конечной концентрации 1:10 000 с последующим прогреванием при 56 °С в течение 30 мин.
Обеззараживание исследуемого материала осуществляли в соответствии с санитарно-эпидемиологическими правилами СП 1.3.3118-13 «Безопасность работы с микроорганизмами I–II групп патогенности (опасности)» [17] путем добавления к исследуемой пробе мертиолята натрия до конечной концентрации 1:10 000 с последующим прогреванием при 56 °С в течение 30 мин.
Статистическую обработку полученных результатов проводили с использованием пакета прикладных программ Statistica 6.0. Для выявления статистической значимости различий результатов использовали t-критерий Стьюдента при уровне достоверности p ≥ 0,95.
Результаты и обсуждение
Выявленная в ходе исследования динамика показателей активации базофилов (СD63+) бруцеллином представлена на рис. 1.
В контрольной группе уровень активированных бруцеллином базофилов в среднем составил 2,38 ± 0,37% (0,12– 4,74%).
При изучении чувствительности к возбудителю бруцеллеза на 30-е сутки после вакцинации установлена выраженная аллергизация антигенами бруцелл организма привитых, среднее количество активированных бруцеллином базофилов составило 19,03 ± 1,42% (11,99–27,64%).
Через 12 месяцев после проведения профилактических противобруцеллезных прививок у 35,3% обследованных выявлена повышенная чувствительность к возбудителю бруцеллеза: уровень активированных бруцеллином базофилов составлял в среднем 10,31 ± 1,19% (6,74–14,5%).
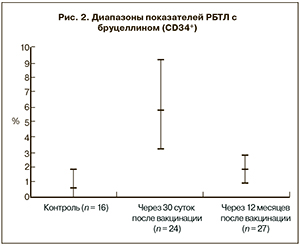
При постановке РБТЛ с иммуннофенотипическим учетом результатов в контрольной группе количество бластных форм лимфоцитов до и после активации бруцеллином не имело статистически значимой разницы, составив в среднем 0,52 ± 0,12 и 0,59 ± 0,11% соответственно (рис. 2).
Анализ напряженности клеточного противобруцеллезного иммунитета в РБТЛ у лиц, обследованных на 30-е сутки после вакцинации, позволил установить повышение специфической клеточной сенсибилизации, что выражалось в статистически значимом увеличении количества бласт-трансформированных лимфоцитов при активации бруцеллином с 0,84 ± 0,07 до 5,80 ± 0,48% (3,21–9,17%).
Через 12 месяцев после вакцинации наличие выраженного клеточного иммунитета к возбудителю бруцеллеза было выявило у 23,5% привитых. При этом у 76,5% уровень клеточной активации бруцеллином был значительно ниже, чем в группе вакцинированных, обследованных на 30-е сутки после иммунизации (1,91 ± 0,17%), однако выше показателей в контрольной группе (0,59 ± 0,11 %; см. рис. 2).
Для выявления степени сенсибилизации макроорганизма перспективным объектом исследования являются базофилы, которые играют центральную роль в реакциях гиперчувствительности немедленного типа. Специфическая особенность базофилов подобным образом реагировать при взаимодействии с аллергенами стала основой для разработки предложенного метода in vitro оценки активации базофилов бруцеллином с последующей детекцией результатов реакции с помощью проточной цитофлуориметрии.
Одним из основных признаков активации лимфоцитов является интенсивность пролиферативной активности в РБТЛ. Данные показатели объективно отражают способность сенсибилизированных лимфоцитов к пролиферации и дифференцировке в ответ на антигенный стимул и характеризуют функциональное состояние активированных Т-лимфоцитов, что можно использовать как маркер, указывающий на степень повышенной чувствительности, а соответственно и напряженности иммунитета. Интенсивность пролиферативного ответа лимфоцитов на антигены дает представление о выраженности специфической сенсибилизации организма.
Таким образом, предложена новая методика оценки напряженности иммунитета против бруцеллеза, которая значительно упрощает учет и увеличивает объективность результатов РБТЛ за счет использования высокоспецифичных моноклональных антител против CD34+ и проточно-цитометрического анализа.
Разработанный метод количественной оценки специфической сенсибилизации макроорганизма к возбудителю бруцеллеза in vitro, позволяет осуществлять постановку и учет реакции в течение двух часов, исключает ложный результат и дополнительную аллергизацию.
В проведенных исследованиях показана принципиальная возможность и перспектива использования методов антигенной активации лейкоцитов in vitro и технологии проточной цитометрии при обследовании лиц, подлежащих вакцинации против бруцеллеза.
Для оценки уровня напряженности противобруцеллезного иммунитета рекомендуется применять РБТЛ с выявлением бластных форм клеток моноклональными антителами к CD34+ с последующим учетом результатов реакции с использованием проточного цитометра.
При лабораторном обследовании лиц, подлежащих вакцинации (ревакцинации) против бруцеллеза, с целью выявления повышенной чувствительности (аллергизации) организма к бруцеллезному антигену рекомендуется использовать тест активации базофилов с иммунофенотипической детекцией экспрессии маркера дегрануляции (CD63+) с помощью проточной цитометрии.


