Хронические заболевания печени являются актуальной медико-социальной проблемой, что связано с широким спектром этиологических факторов их возникновения, тяжелым клиническим течением, неуклонным прогрессирующим течением с развитием фиброза, а затем и цирроза печени (ЦП). При этом наиболее частой причиной развития хронических диффузных заболеваний печени является ее инфицирование вирусами гепатитов В и С [1], распространенность которых в мире и в нашей стране неуклонно возрастает за счет заболеваемости хроническими формами вирусных гепатитов (ХВГ), особенно гепатита С [2, 3]. Остается актуальным поражение печени токсической этиологии, в том числе алкогольной и лекарственной, что также приводит к фибротическим изменениям печени, а затем и к ЦП [1, 4, 5]. Смертность от терминальной стадии фиброза печени (ФП) занимает 9-е место в мире среди всех причин смерти и 6-е – среди лиц наиболее трудоспособного возраста, составляя от 14 до 30 случаев на 100 тыс. населения. В России эти показатели значительно выше и, по разным источникам, достигают 60,5 случая на 100 тыс. населения [1, 2, 6]. Крайне неблагоприятным остается наличие высокого риска развития гепатоцеллюлярной карциномы (в 30 раз чаще) у пациентов с ФП [6, 7].
За последние десятилетия вопросам оценки ФП посвящена масса как клинических, так и экспериментальных исследований. Предприняты попытки стандартизации правил ведения пациентов с продвинутым фиброзом и ЦП, определена тактика применения ряда патогенетических препаратов. Однако остаются нерешенными вопросы ранней диагностики ФП, определения маркеров прогрессирования фиброза и прогностических маркеров фатальных осложнений. Во многом результаты проведенных исследований остаются довольно противоречивыми, что значительно затрудняет работу клинициста. Прогнозирование течения и исходов хронических гепатитов различной этиологии – актуальная и чрезвычайно сложная задача, решение которой определит выбор адекватной тактики ведения больного. Для этого должны использоваться показатели, характеризующиеся высокой прогностической ценностью, чувствительностью и специфичностью. В данном обзоре анализируются современные представления о фиброгенезе печени и популярные методы его определения.
Механизмы формирования ФП
Механизм развития ФП вытекает из многогранности морфологической реакции печени на повреждение: стеатоза, пигментного отложения, тромбоза, апоптоза, некроза, адаптации, пролиферации гепатоцитов и собственно фиброзных изменений. При этом, независимо от этиологического фактора, только выраженность фиброза определяет, на какой стадии находится заболевание, то есть именно фиброз отражает темпы прогрессирования хронических диффузных поражений печени. Степень прогрессирования и выраженности фиброза определяется нарушением баланса между образованием и деградацией фиброзной ткани, которые регулируются профиброгенными и антифиброгенными факторами [6, 8, 9].
Фиброгенез – универсальный процесс прогрессирования хронических заболеваний печени, не зависящий от этиологических факторов, связанный с заменой паренхиматозных клеток соединительной тканью. Основу фиброгенеза составляет избыточное накопление протеинов внеклеточного матрикса и тканевых коллагеназ, основным источников которых являются звездчатые клетки (ЗК) печени [10]. В нормальной печени они (липоциты, клетки Ито) находятся в состоянии покоя и, накапливая ретиноиды, производят протеины внеклеточного матрикса. Активация ЗК медиаторами клеточного воспаления, к которым можно отнести активные формы кислорода, секретируемые поврежденными гепатоцитами, тромбоцитарный фактор роста (PDGF), фактор роста фибробластов (FGF), трансформирующий фактор роста β1 (TGF-β1), фактор некроза опухоли α (TNF-α), фактор роста гепатоцитов, интерлейкин-1 (ИЛ-1) и др., является основным патогенетическим звеном фиброгенеза [2, 11, 12] (см. рисунок). ЗК перемещаются в зону центральной вены, активируются, становятся похожими на миофибробласты, активно пролиферируют и теряют запасы ретиноидов.
Активированные ЗК становятся главным источником избыточной продукции внеклеточного матрикса. Накопление фибриллообразующих коллагенов в пространстве Диссе приводит к «капилляризации» и нарушению архитектоники печени, что препятствует нормальному обмену между синусоидами и гепатоцитами [12, 13].
Таким образом, активированные ЗК являются главным источником накопления внеклеточных матричных компонентов, таких как коллаген I, III и IV типов, фибронектин, ламинин и другие. Кроме того, ЗК продуцируют ферменты, участвующие в процессе фибролиза, – матриксные металлопротеиназы (ММП), играющие основную роль в расщеплении компонентов внеклеточного матрикса. Протеолитическая активность ММП может быть блокирована тканевыми ингибиторами матриксных металлопротеиназ (ТИМП-1, ТИМП-2) – группой белков, также секретируемых ЗК. Поэтому активированные ЗК играют большую роль не только в синтезе фиброзной ткани, но и в ее разрушении [14, 15].
В благополучных условиях в печени существует баланс между процессами образования и разрушения компонентов внеклеточного матрикса. Именно поэтому в здоровой печени не происходит избыточного накопления коллагена вследствие его постоянного протеолиза. При патологии многочисленные повреждающие факторы запускают процессы, приводящие к чрезмерному синтезу и накоплению продуктов распада внеклеточного матрикса, а также способствуют нарушению деградации молекул внеклеточного матрикса. При этом молекулярный состав измененной соединительной ткани печени всегда однотипен, вне зависимости от этиологического фактора формирования фиброза. Молекулы внеклеточного матрикса объединяются в большие молекулярные образования – коллагены, неколлагеновые гликопротеиды, протеогликаны, гликозаминогликаны, эластин, гиалуронан (см. рисунок) – и депонируются как в перицентральных зонах печеночного ацинуса, так и в перипортальных участках [10, 16, 17].
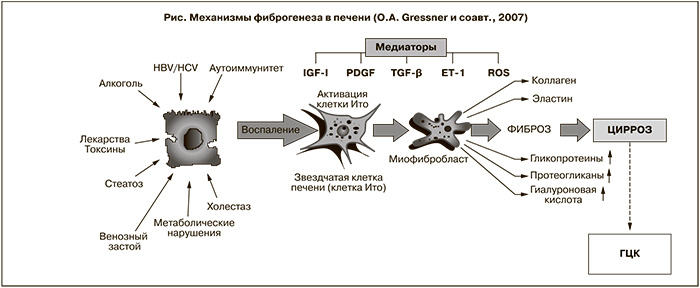
Кроме этого происходит деградация внеклеточного матрикса, осуществляющаяся двумя основными путями: либо в процессе разрушения нормального субэндотелиального матрикса здоровой печени, что еще более ухудшает ее состояние, либо путем восстановления печеночной паренхимы при распаде избыточной фиброзной ткани. Регуляцию процессов деградации обеспечивают ММП-1, ММП-2 и ММП-9 и их тканевые ингибиторы [18, 19]. Непосредственными факторами управления фиброгенезом являются универсальные (а в ряде случаев специфические) цитокины, регулирующие воспалительный ответ на повреждение гепатоцитов. К известным стимуляторам фиброгенеза можно отнести моноцитарный хемотаксический белок 1-го типа, фактор роста TGF-β1, способствующий трансформации ЗК в миофибробластоподобные клетки, стимулируя синтез внеклеточного матрикса и ингибируя его деградацию. Именно поэтому продолжается поиск лекарственных средств, воздействующих на TGF-β1, что значимо могло бы снизить темпы фиброза [20]. К фиброгенным субстанциям относят и мощный митоген ЗК – PDGF, который приводит к нарушению их регуляции в печени с последующим прогрессированием фиброзных изменений. Провоспалительный ИЛ-10 и интерферон-γ при этом оказывают мощное антифибротическое действие [11, 14, 20]. Цитокины с вазоактивными свойствами также играют важную роль в процессе формирования и прогрессирования ФП. Так, вазодилатирующие субстанции, такие как оксид и нитрит азота, релаксин, обладают антифибротическими свойствами, в то время как вазоконстрикторам (норадреналин и ангиотензин II) принадлежит главенствующая роль в фиброгенезе печени. Мощный вазоконстриктор эндотелин-1 тоже стимулирует темпы прогрессирования фиброзных изменений в ткани печени [21].
Таким образом, понятно, что фиброгенез печени – активный биосинтетический репаративный процесс, приводящий к избыточному депонированию компонентов внеклеточного матрикса, в основном коллагена, формирующего механический каркас органа. И при прогрессирующем разрастании фиброзной ткани появляются предпосылки к формированию ЦП – конечной стадии ее фиброза с организацией узелковых структур в паренхиме и нарушением печеночных функций [6].
Эволюция фиброза в ЦП – это не просто процессы рубцевания и замещения соединительной тканью, а часть хронического поражения печени, включающая воспаление, ангиогенез, ремоделирование и образование коллагена. По сути, выраженность фиброза и размеры узлов являются предикторами значимой портальной гипертензии (ПГ; более 10 мм рт. ст.), с которой и связан дальнейший прогноз заболевания. Исходя из известных данных об особенностях строения портального русла, его связей с другими системами организма, можно сформулировать основные физиологические механизмы, определяющие уровень давления в воротной вене [22, 23]: внутрипеченочная и портальная сосудистая резистентность, объем крови в портальном русле печени и состояние сердечно-сосудистой системы.
Известно, что предикторами ФП являются холестаз во всех проявлениях, возраст старше 45 лет (так как к этому моменту процессы заместительного фиброгенеза протекают быстрее), мужской пол как фактор риска развития ПГ, вирусная инфекция, синдром перегрузки железом, злоупотребление алкоголем, инсулинорезистентность, некорригируемая ПГ, сопутствующая сердечная недостаточность. Степень фиброзных нарушений коррелирует с тяжестью микроциркуляторных расстройств на уровне крупных сосудов печени и в синусоидах, усугубляя состояние гипоксии, радикального окисления, эндотелиальной дисфункции и стимуляции фиброгенеза. Несмотря на существование большого количества исследований и методов диагностики ФП, эта проблема остается до конца не решенной и перспективной для дальнейшего изучения.
Методы оценки ФП
В настоящее время предлагается множество методов оценки фиброза, которые можно разделить на несколько групп.
Инструментальные методы
1. Биопсия печени. Известно, что «золотым стандартом» для определения стадии ФП является пункционная биопсия печени. Однако у этого метода имеется ряд ограничений, таких как инвазивность процедуры, риск развития осложнений в 0,01–0,1% случаев (рефлекторная гипотония, кровотечение, подкапсульная гематома печени, повреждение соседних органов, летальный исход), погрешности в получении материала и др. [24, 25]. На основании результатов данной процедуры можно диагностировать ФП с достаточно высокой степенью специфичности. Однако это важное инвазивное исследование проводится только в специализированных лечебных учреждениях, требует высокого профессионализма от гепатолога и патоморфолога. К сожалению, при проведении гепатобиопсии возможно развитие осложнений до 3% случаев, а в 15–35% получают неизмененную ткань печени и в 1,5% – неинформативный материал [24]. В клинической практике биопсию печени трудно использовать для оценки динамики ФП. Метод недостаточно чувствителен, так как объем исследуемой ткани составляет всего около 1/50 000 органа [26]. При этом тяжесть поражения печени в трети случаев недооценивается или, наоборот, переоценивается [19, 27], а один и тот же биоптат разные морфологи могут трактовать по-разному [19].
2. Эластография печени. Оценка выраженности фиброза посредством измерения эластичности печени с помощью аппарата фиброскан основана на генерации низкочастотных колебаний, передающихся на ткань печени. Принципом методики является использование колебаний низкой частоты для количественной оценки эластичности как показателя состояния печени и доли в ней соединительной ткани. Эластичность ткани печени (в килопаскалях – kPa) определяют по скорости распространения в печени упругих волн, генерируемых прибором. Объем исследуемой ткани достигает 6 см3 и значительно превосходит таковой при биопсии печени. Доказана положительная корреляционная связь между результатами, полученными при эластографии и биопсии печени. Максимальная диагностическая точность эластометрии отмечена у больных ХВГ со стадиями фиброза F3 – 92,5%, F4 – 96%, что сопоставимо с результатами полуколичественной морфологической оценки по системе METAVIR. Чувствительность эластометрии для стадии F1 составила 66%, специфичность – 83%. Факторами, влияющими на диагностическую точность эластометрии, являются возраст пациента моложе 50 лет – 95% (p < 0,0001), индекс массы тела (ИМТ) менее 25 кг/м2 – 95% (p < 0,0001) [28, 29].
3. Визуализирующие методы обследования. Широко распространенные и доступные методы визуального неинвазивного обследования (ультразвуковая диагностика, компьютерная томография, магнитно-резонансная эластография) могут применяться для установления диагноза ФП, признаков ПГ, ряда сосудистых нарушений (допплерография сосудов портальной системы), однако их диагностическая информативность низка.
 Лабораторные методы диагностики ФП
Лабораторные методы диагностики ФП
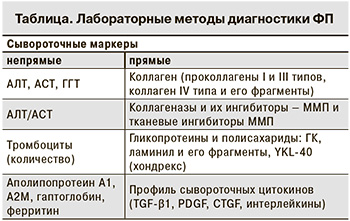
Выделяют прямые и непрямые сывороточные маркеры фиброгенеза (см. таблицу).
Непрямыми являются традиционно используемые в клинической практике маркеры, характеризующие изменение функции печени, и соединения, синтезируемые, регулируемые или секретируемые печенью:
- аминотрансферазы: аспартатаминотрансфераза (АСТ), аланинаминотрансфераза (АЛТ) – наиболее чувствительный и специфичный индикатор гепатоцеллюлярного повреждения; соотношение уровней АСТ/АЛТ (коэффициент Де Ритиса);
- гамма-глутамилтранспептидаза (ГГТ). Известно 5 патологических процессов, способствующих повышению активности ГГТ: цитолиз, холестаз, интоксикация алкоголем, опухолевый рост в печени, воздействие гепатотоксичных препаратов (лекарственный гепатит) и др.;
- аполипопротеин А1 – основной аполипопротеин, входящий в состав липопротеинов высокой плотности. Является весьма перспективным маркером некровоспалительных процессов, связанных с фиброзом: с повышением стадии фиброза сывороточный уровень аполипопротеина А1 снижается;
- альфа-2-макроглобулин (А2М) – маркер тяжести воспалительного процесса в печени, белок острой фазы воспаления; активирует стеллатные клетки и стимулирует фиброгенез. Сывороточный гликопротеин, основной ингибитор протеолитических каскадных систем: комплемента, коагуляции и фибринолиза;
- количество и функция тромбоцитов – показатель тяжести фиброза, хотя также отражает выраженность гиперспленизма; показано, что количество тромбоцитов < 150 х109/л имело предиктивное значение для стадии ФП F4 (90%), а при стадиях F1–F3 – у 75–80% пациентов [12, 28].
- гаптоглобин – связывает свободный гемоглобин, высвобождающийся из эритроцитов, является важным реактантом острой фазы. Пониженный гаптоглобин – маркер тяжести воспалительного процесса в печени; уровень гаптоглобина значительно снижен у пациентов с ЦП;
- ферритин – острофазовый белок. В исследованиях обмена железа изучены концентрации ферритина, железа, трансферрина у больных ХВГ. Показано, что наиболее грубые нарушения в метаболизме железа с достоверным повышением концентрации ферритина и железа имели место при стадиях F3– F4, а при стадиях F1–F2 уровни ферритина и железа не имеют существенных отличий [30].
Перечисленные маркеры эффективны для диагностики воспалительных процессов в печени, показательны при нарушении функционирования гепатоцитов и снижении белково-синтетической функции печени. Однако непрямые сывороточные маркеры фиброгенеза не могут отобразить степень повреждения печеночной паренхимы.
Потому сегодня наиболее актуальны непрямые маркеры, методом дискриминантного анализа объединенные в комплексные тесты (фиброакти-тест, фибромакс-тест, стеатоскрин и др.). По данным фибротеста, для стадии F1 чувствительность метода составила 70%, специфичность – 85%, для F2 – 80 и 100% соответственно, для F3–F4 – 100 и 100% [28, 31].
В настоящее время наиболее перспективными для изучения и внедрения в клиническую практику являются прямые маркеры фиброгенеза (см. таблицу), отражающие изменения во внеклеточном матриксе. К ним относятся регуляторы процессов деградации внеклеточного матрикса печеночной паренхимы – матриксные коллагеназы (ММП-1) и желатиназы (ММП-2, ММП-9) и их ингибиторы, продукты синтеза коллагена, гликопротеиды, полисахариды, а также некоторые цитокины.
MMП – большое семейство ферментов, эндопептидазы, участвующих в ремоделировании соединительной ткани посредством разрушения ее органических компонентов: коллагена, протеогликанов, эластина, ламинина, фибронектина. ММП-2 секретируется активированными ЗК, ММП-9 – в основном активированными клетками Купфера. ММП-2 и ММП-9 коррелируют с фиброзом [32, 33], но некоторые исследования по изучению корреляции ММП-2 при ХГС дали противоречивые результаты [15].
ТИМП-1 и ТИМП-2 продуцируются фибробластами, а ТИМП в гепатоцитах активирует синтез ИЛ-6 и ИЛ-1β. Основной функцией ТИМП является регуляция разрушения коллагена и компонентов базальной мембраны. Соотношение ММП-2/ТИПМ-1 считается более информативным маркером ЦП у больных ХГС. Однако они не способны дифференцировать степень выраженности фиброза, поэтому их клиническая значимость была продемонстрирована только на продвинутых стадиях ФП [32].
N-терминальный пептид проколлагена III (N-terminal peptide of procollagen III – PIIINP) – продукт расщепления коллагена, является наиболее широко изученным маркером ФП [34]. Маркер обнаружения цирроза с чувствительностью около 94% и специфичностью около 81% [35, 36]. При ХГС уровень PIIINP не коррелирует со степенью фиброза [37, 38], но может быть повышен при остром и хроническом активном гепатите и коррелирует с уровнями аминотрансфераз [36]. Однако PIIINP не является специфичным для ФП, поскольку его уровень также повышается при фиброзе легких, хроническом панкреатите и ревматоидном артрите [39]. Поэтому PIIINP скорее маркер воспаления, чем фиброза.
Коллаген IV типа рассматривается как предполагаемый маркер формирования базальной мембраны и синусоид капилляризации, которые являются важными патологическими процессами в ФП. Сывороточный уровень коллагена IV типа может быть использован для прогнозирования состояния ФП при ХВГ [12, 20, 37, 40], алкогольных заболеваниях печени и печеночно-клеточный карциноме.
Гиалуроновая кислота (ГК; Hyaluronic acid) – высокомолекулярный полисахарид с неразветвленной основной цепью, в основном продуцируется фибробластами и другими специализированными клетками соединительной ткани. Она играет структурную роль в соединительнотканном матриксе и участвует в различных межклеточных взаимодействиях. Было показано, что рост уровня гиалуроновой кислоты ГК лучше корреллирует со степенью гистологического повреждения печени, чем традиционные тесты оценки функции печени [40]. Определение сывороточного уровня ГК важно для диагностики ЦП, оценки степени ФП, мониторинга функции печени. Было также показано, что уровень ГК отражает степень ФП у пациентов с ХГС [25, 41], алкогольным циррозом и первичным билиарным циррозом. Уровень ГК является также ранним маркером токсического повреждения печени этанолом, ацетаминофеном, бактериальными липополисахаридами [5] .
Хрящевой гликопротеин YKL-40 (хондрекс) участвует в расщеплении экстрацеллюлярного матрикса. Полагают, что сывороточный уровень YKL-40 тесно связан со степенью ФП. YKL-40 был испытан у пациентов с гепатитом С и продемонстрировал чувствительность и специфичность для фиброза около 80% [42]. При алкогольной болезни печени специфичность составляет 88%, чувствительность – 51% [42]. YKL-40 может отражать клинический исход [34]. Недостатком YKL-40 является его повсеместное присутствие и, следовательно, он не может считаться специфическим маркером ФП [19, 38].
Ламинин (Laminin) – крупный адгезивный гликопротеин, является ключевыми компонентами базальных мембран. Синтез ламинина происходит в печеночной паренхиме в ходе регенеративных процессов, и при ФП ламинин в большом количестве накапливается во внеклеточном матриксе [35, 37, 43].
Эндотелин-1 (Еndothelin-1) – маркер состояния эндотелия. При хронических диффузных заболеваниях печени происходит нарушение кровообращения в печени на фоне эндотелиальной дисфункции. Эндотелин-1 также активирует ЗК печени, что способствует развитию фиброза. По некоторым данным, может использоваться для дифференциальной диагностики минимального/умеренного фиброза и ЦП при хронических гепатитах [21].
TGF-β1 (transforming growth factor β1) является основным индуктором активации ЗК. Концентрация TGF-β1 в плазме повышена и коррелирует с тяжестью заболевания печени. Было показано, что TGF-β1 хорошо коррелирует с наличием ФП у пациентов с алкогольной болезнью печени и при ХГС [44]. Однако его повышение четко коррелирует с уровнем АЛТ и АСТ, поэтому TGF-β1 – более маркер воспаления [45–47], а не фиброгенеза.
PDGF (рlatelet derived growth factor) продуцируется клетками Купфера, является сильным митогеном, вызывает миграцию и пролиферацию мезенхимальных клеток, в том числе ЗК, к месту повреждения. Фактор роста соединительной ткани (connective tissue growth factor – CTGF) синтезируется ЗК и гепатоцитами и сильно зависит от наличия TGF-β1 [17], является основным регулятором в переходе эпителиальных клеток в мезенхимальные, которые играют ключевую роль в увеличении внеклеточного матрикса. Недавние исследования показали, что уровень CTGF уменьшается при конечной стадии цирроза. Таким образом, CTGF был предложен в качестве ценного маркера активного фиброгенеза [46].
Цитокератин 18 (сaspase-cleaved cytokeratin 18 – CK18-Asp396) – белок, выходящий из гепатоцитов при их апоптозе. Является перспективным маркером хронических заболеваний печени. У больных неалкогольным стеатогепатитом (НАСГ) концентрация CK18-Asp396 выше, чем у пациентов с ХВГ, что указывает на более выраженный и значительный апоптоз при НАСГ [18]. На данный момент CK18-Asp396 – единственный маркер, специфичный именно для НАСГ.
Принципиальное ограничение достоверности прямых биомаркеров фиброза состоит в том, что они могут повышаться и при других состояниях: отражают не избыточное отложение протеинов внеклеточного матрикса, а тканевой метаболизм в целом и не обладают специфичностью для ткани печени. Проведенные клинические исследования показывают, что маркерами прогрессирования фиброза являются повышение содержания коллагена IV типа, ГК, PIIINP и ТИМП-1. Маркерами стабильного течения фиброза являются снижение в сыворотке крови коллагена IV типа и ГК. При этом прослеживаются корреляции между показателями этих маркеров в крови и гистологическими индексами стадий ФП. Однако, несмотря на довольно большое количество исследований, диагностическая точность таких корреляций неоднозначна.
Е.В. Винницкая [20] при оценке диагностической значимости сывороточных маркеров при хронических диффузных заболеваниях печени выявляет статистически значимую комбинацию следующих маркеров: ГК, ТИМП-1 и ТИМП-2, коллаген IV типа, уровень АСТ и щелочной фосфотазы, которые коррелируют с ФП. Т. Wang и соавт. [40] установили высокий уровень корреляций между различными стадиями ФП у 127 пациентов и концентрациями ГК, коллагена VI типа, PIIINP и ТИМП в сыворотке крови. Причем показатели содержания указанных маркеров тесно коррелировали как со степенью воспаления, так и со стадией фиброза: чем более выраженным было поражение печени, тем выше были показатели указанных маркеров в сыворотке крови.
D.J. Leeming и соавт. [23] оценивали значимость сывороточных маркеров фиброза для обнаружения ПГ. Было выявлено, что все основные маркеры ремоделирования внеклеточного матрикса достоверно коррелируют с градиентом печеночного венозного давления, но сочетанное измерение эластина, коллагена VI типа и PIIINP значительно лучше отображают степень ПГ [23].
Y. Murawaki и соавт. [25], обследовавшие 169 больных с XГС, показали высокую диагностическую роль повышенных концентраций ММП, ГК, коллагена VI типа и PIIINP и ТИМП для дифференцировки стадии фиброза F1–F2 от F3–F4. Они выявили также, что определение ГК имеет наибольшую значимость по сравнению с другими тестами при диагностике умеренного и выраженного ФП (при уровне ГК > 50 пг/мл чувствительность теста составила 77%, специфичность – 75%) и для выраженной степени воспаления (при уровне ГК > 60 пг/мл чувствительность – 75%, специфичность – 80%).
А. Sanvisens и соавт. [41] показали, что у пациентов с XГС сывороточный уровень ГК положительно коррелировал со степенью фиброза, а диагностические характеристики теста для разграничения слабого/выраженного фиброза и ЦП были достаточно высоки: чувствительность составила 87,0%, специфичность – 70,0%.
Y.X. Zhang и соавт. [48], обследовав 177 взрослых пациентов с ХГВ, определили, что отсекающее значение ГК для диагностики тяжелого фиброза составляет > 300,0 пг/мл при чувствительности 93,7% и специфичности 98,9%. В своем исследовании авторы указали, что cepoлогический уровень ТИМП-1 положительно коррелировал со значениями индекса гистологической активности у больных с XГВ.
I. El-Gindy и соавт. [49] показали, что уровни MMП-2 в сыворотке крови не различались у больных ХГС с ФП, без фиброза и в контрольной группе, но были достоверно выше у больных с ЦП. Концентрация ТИМП-1 была повышена у всех пациентов, независимо от стадии фиброза, по сравнению с контрольной трупной. Авторами была показана высокая диагностическая значимость MMП-2 для выявления ЦП: чувствительность теста – 83%, специфичность – 96%. Содержание ТИМП-1 в сыворотке крови позволило определять наличие цирротической трансформации печени с чувствительностью 100% и специфичностью 75%. С другой стороны, по мнению S. Reif и соавт. [50], сывороточные уровни ММП-2 и MMП-9 отражают степень воспалительной активности, но не стадию ФП у больных ХГС.
Совершенно очевидно, что каждый из указанных показателей в отдельности может не обладать высокой прогностической ценностью. Большинство исследований сывороточных маркеров фиброза показывают, что использование этих маркеров в качестве одиночных тестов ограничено в связи с ложноположительными результатами при наличии воспалительного процесса в печени, а также они неспецифичны для печеночной ткани и могут отражать фибротические процессы, происходящие в других органах [5]. Поэтому ряд авторов исследуют и предлагают комбинированные системы оценки фиброза, которые основаны на сочетанном определении маркеров фиброгенеза [28, 31] и оценке на фиброскане. При этом достигается увеличение специфичности для сывороточных маркеров объединением в комплексные фиброзные панели, включающие прямые и непрямые биомаркеры. К сожалению, они имеют свои ограничения и недостатки, являются дорогостоящими, а максимальная диагностическая точность отмечена у больных со стадией фиброза F3–F4 [28, 30].
Широкое использование комбинации неинвазивных методов для диагностики ФП позволит уменьшить число биопсий при ХВГ. Очевидно, что в настоящее время необходимо определить значимые маркеры ранней диагностики ФП и выявить критерии прогрессирования фиброза в зависимости от этиологии ХВГ, а также разработать методы коррекции ФП.
Своевременная и точная оценка выраженности ФП поможет вовремя начать целенаправленное лечение, что существенно улучшит прогноз и качество жизни пациентов.


