Стрептококки группы А (СГА) – этиологические агенты щирокого спектра клинических форм убиквитарно распространенных заболеваний. Полиморфизм клинических проявлений СГА-инфекции в значительной степени определяется типовой структурой и изменчивостью возбудителя, которая может приводить к формированию вариантов СГА с повышенным эпидемическим и патогенным потенциалом. Считается, что уровень заболеваемости респираторными и кожными формами инфекции коррелирует с экономическим развитием страны, и в развитых странах такой показатель минимален [1]. Случаи инвазивных форм СГА-инфекции (ИСИ) регистрируются в разных регионах мира, независимо от социально-экономических условий. В связи с опасностью стремительного нарастания симптомов подобных форм заболевания с возможным развитием синдрома токсического шока и летального исхода решающую роль приобретают экспрессная лабораторная идентификация возбудителя и рациональный выбор лекарственных средств. Для оценки эпидемической ситуации важное значение имеет изучение молекулярно-биологических и генетических свойств циркулирующих стрептококков.
Цель работы – оценка возможности использования коммерческих тест-систем, разработанных для экспресс-идентификации СГА в мазках из глотки, при инфекциях мягких тканей и изучение антибиотикочувствительности и молекулярно-генетических свойств возбудителя, выделенного от больных в хирургическом стационаре.
Материалы и методы
Исследование проводили с мая 2008 г. по март 2011 г. и с ноября 2013 г. по май 2014 г. в гнойно-хирургическом отделении Городской клинической больницы № 23 имени «Медсантруд» (Москва). Всего за исследуемый период (2008–2011) в отделении проходили лечение 4750 пациентов, истории болезней которых были проанализированы. К инвазивным инфекциям были отнесены 132 случая. СГА-этиология была установлена в 46 случаях. Изучение молекулярно-генетических свойств СГА проводили на 35 штаммах, выделенных от больных с ИСИ, и на 66 штаммах от пациентов с другими диагнозами. Большую часть штаммов (91 культура) испытывали на чувствительность к антибиотикам. Апробацию экспрессного метода диагностики СГА осуществляли в 2013–2014 гг.
 СГА выделяли из крови или материала, полученного во время операции при первичном нарушении целостности кожного покрова. Посев пробы осуществляли на кровяной агар с добавлением 5% крови барана. После учета результатов первичного посева на агар выделяли чистую культуру и культивировали ее в бульоне Тодда–Хьюита («HiMedia Laboratories Pvt. Ltd.», Индия) в течение 18 ч при 37 °С. Идентификацию СГА проводили методом латекс-агглютинации с использованием набора реагентов для групповой идентификации Slidex Strepto-Kit («bioMerieux», Франция).
СГА выделяли из крови или материала, полученного во время операции при первичном нарушении целостности кожного покрова. Посев пробы осуществляли на кровяной агар с добавлением 5% крови барана. После учета результатов первичного посева на агар выделяли чистую культуру и культивировали ее в бульоне Тодда–Хьюита («HiMedia Laboratories Pvt. Ltd.», Индия) в течение 18 ч при 37 °С. Идентификацию СГА проводили методом латекс-агглютинации с использованием набора реагентов для групповой идентификации Slidex Strepto-Kit («bioMerieux», Франция).
Наличие генов бактериофаговых токсинов speA, speC, а также гена токсина speB, кодируемого хромосомой, определяли методом ПЦР при условиях, описанных ранее [2]. Амплификацию фрагмента гена speB проводили с использованием праймеров: 5’-ACTTATGCTGGTACCGCTGAG-3’; 5’-GAGAGCTACCTGCAGAACCAC-3’. emm-типирование культур СГА проводили в соответствии с протоколом, рекомендованным Centers for Disease Control and Prevention (CDC, США) [http://www.cdc.gov/ncidod/biotech/strep/protocol_emm-type.htm]. Фрагменты ДНК выделяли из агарозного геля посредством набора Bacterial Genomic DNA Miniprep kit («Axygen», США). Принадлежность штамма к определенному кластеру определяли в соответствии с предложенной системой типирования [3].
Секвенирование ДНК проводили с использованием набора BigDye v.3.1 («Applied Biosystems», США) на генетическом анализаторе ABI 3130x1 согласно инструкции производителя. С целью установления emm-типа и emm-подтипа штаммов полученные последовательности сравнивали с данными, опубликованными в Streptococcus pyogenes emm sequence database [http://www.cdc.gov/ncidod/biotech/strep/strepblast.htm] c помощью программы BLAST2.
Чувствительность к антибиотикам с определением минимальной подавляющей концентрации исследовали методом микроразведений в катион-сбалансированном бульоне Мюллера–Хинтона (BBL, США) с добавлением лизированной лошадиной крови (итоговая концентрация – 5%). Для приготовления бактериальной суспензии суточную культуру стрептококков разводили стерильным физиологическим раствором до мутности, эквивалентной 0,5 по стандарту Мак-Фарланда. Инкубацию микротитровальных планшетов проводили в течение 18 ч при 35 °С. Для контроля качества использовали референтный штамм S. pneumoniae ATCC 49619. Интерпретацию результатов определения чувствительности осуществляли согласно критериям Европейского комитета по определению чувствительности к антибиотикам (EUCAST, v.4.1.).
При испытании коммерческих тест-систем, разработанных для экспресс-идентификации СГА в мазках из глотки при ангине, биологический материал забирали у 81 больного с гнойно-воспалительными заболеваниями мягких тканей, оперированного в период с ноября 2013 г. по май 2014 г. Пациенты были в возрасте от 19 до 83 лет мужского и женского пола. Использовали экспресс-тест-систему второго поколения на основе иммунохроматографического метода «СТРЕПТАТЕСТ», а также классический микробиологический метод. При использовании классического микробиологического метода мазок с тампона переносили на чашку с кровяным агаром через 2–24 ч. Рассев заканчивали уколами в глубину агара для создания условий, приближенных к анаэробным. Посев изучали после выращивания в термостате при 37 °С в течение 18–20 ч. При отсутствии колоний с бета-гемолизом инкубирование продолжали до 48 ч.
Результаты и обсуждение
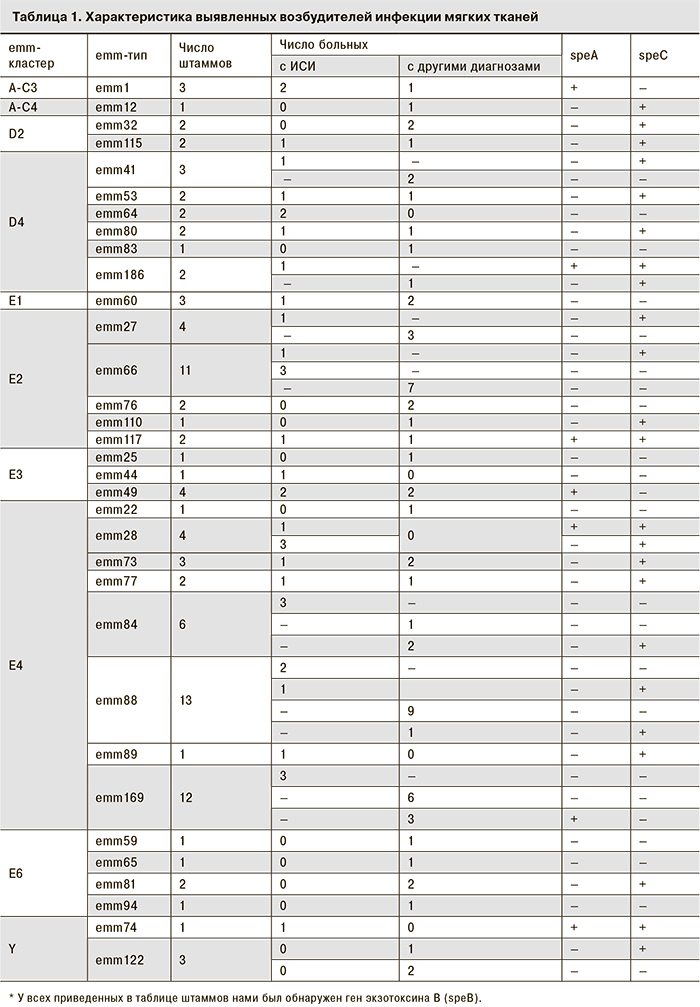
Среди выделенных культур СГА определили 34 различных emm-типа, при этом практически половина из них относились к 6 типам: emm169 (st1731), emm88.2, emm49.8, emm66.0, emm28, emm84.0 (табл. 1).
За период наблюдений было зарегистрировано 46 случаев инвазивных инфекций, вызванных или монокультурами СГА, или культурами возбудителя совместно с другими патогенными микроорганизмами. СГА вызывал развитие ИСИ в 25,0% случаев в качестве монокультуры, отличаясь более стремительным течением болезни по сравнению с инфекциями, вызываемыми другими видами микроорганизмов, в 9,9% – при микст-инфекции (см. рисунок).
При ИСИ обнаружено 22 различных emm-типа СГА. Наиболее распространенными были emm-типы 66, 28, 88. Культуры с emm-типами 1, 49, 64, 84 и emm169 (st1731) зарегистрированы при ИСИ чаще 1 раза. Штамм 64.0 выделен от 2 больных (один случай с летальным исходом, второй – с тяжелым сепсисом). Летальные исходы также зафиксированы среди пациентов, у которых были выделены СГА emm-типов 1.47, 66.1 и 77.0.
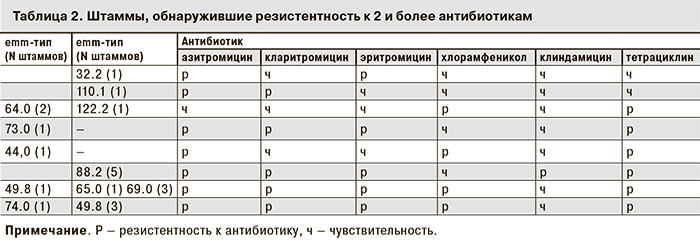
Все исследованные штаммы (91) обнаружили чувствительность к пенициллину, ванкомицину и линезолиду, моксифлоксацину, триметоприму и левофлоксацину (к последнему лишь 1 штамм был умеренно резистентен). 27 (29,7%) штаммов были резистентны только к тетрациклину. Еще 2 (2,2%) штамма, помимо резистентности к тетрациклину, проявили резистентность один – к левофлоксацину, другой – ко всем 3 представителям макролидов (азитромицину, кларитромицину и эритромицину). Из оставшихся 19 штаммов 2 (2,2%), сохраняя чувствительность к тетрациклину, были резистентны к 2 из 3 представителей макролидов, 4 (4,4%) штамма были резистентны к тетрациклину и хлорамфениколу, 13 (14,3%) обнаружили устойчивость к 3 и более представителям классов (групп) антимикробных препаратов, то есть являлись полирезистентными. При этом 12 из 13 штаммов были нечувствительны к тетрациклину и каждому из 3 макролидов (13-й штамм был резистентен к тетрациклину и азитромицину). Дополнительно 8 из них были резистентны к хлорамфениколу, а другие 5 – к клиндамицину.
21 культура, проявившая устойчивость более чем к 1 антибиотику, принадлежала к 11 emm-генотипам (32, 44, 49, 64, 65, 73, 74, 88, 110, 122, st1731). Из них 6 (28,6%) штаммов были связаны с ИСИ и представляли emm-типы 44, 49, 64, 73 и 74. (табл. 2).
Как экспресс-тестом, так и классическим микробиологическим методом получен положительный результат у 6 пациентов с диагнозами «абсцесс волосистой части головы», «флегмона левого предплечья», «гнойный локтевой бурсит», «флегмонозно-некротическая рожа голени» (2 пациента), «некротизирующая инфекция предплечья». У остальных 75 пациентов гнойно-воспалительные заболевания мягких тканей были вызваны Staphylococcus aureus, Staphylococcus epidermidis, Enterococcus spp., Escherichia coli, Acinetobacter spp., Proteus spp. и Pseudomonas aeruginosa. Ложноположительных и ложноотрицательных результатов при использовании экспресс-теста не зарегистрировано.
Определенные emm-типы S. pyogenes часто ассоциируются с развитием той или иной формы СГА-инфекции. В развитых странах СГА-инфекцию вызывает ограниченное, практически неизменное количество клонов возбудителя [4]. В развивающихся странах возбудитель чрезвычайно гетерогенен по своим молекулярно-генетическим свойствам.
В развитых странах более 90% случаев стрептококковой инфекции связано с 25 еmm-типами: emm1 (19%), 3 (8%), 4(7%), 12 (11%), 28 (10%), 89 (5%) и т. д. В развивающихся странах 25 emm-типов вызывали около 62% случаев заболеваний. При этом на Африканском континенте ведущими были в основном те же emm-типы (1, 3, 12, 74, 75), а в странах Тихоокеанского региона – emm55 и группа нетипируемых штаммов. Наиболее распространенный в других регионах emm1 оказался здесь на 13-м месте, а второй по распространенности emm12 в 25 ведущих emm-типов не входил [5].
В нашем исследовании указанные emm-типы также не занимали лидирующих позиций, а наибольшее число случаев было вызвано emm-типами 88, 169 (st1731) и 66 .
emm-типы 88, 169 и 66 насчитывают от 2 до 7 субтипов и, по данным литературы, в эпидемиологических исследованиях стрептококковых инфекций выделялись в незначительном количестве на фоне других чаще встречающихся типов. emm169 лишь на Африканском континенте занимал 13-е место, а emm66 и emm88 не входили в число 25 наиболее распространенных ни в одном из рассмотренных регионов [5]. По данным СDC, emm66 обнаруживали в разное время в США, Бразилии, Аргентине, Мексике и Непале в глоточных мазках и при ИСИ; emm88 ассоциируется в основном с пиодермией, в ряде случаев осложненной сепсисом (Таиланд, Индия, Южная Африка); emm169 (st1731) выделяли из глоточных мазков детей в Непале [CDC, http://www.cdc.gov/streplab/index.html], а также от нескольких больных ИСИ в Израиле [6].
Штаммы, наиболее часто вызывающие развитие ИСИ в европейских странах, принадлежат к emm-типам 1, 3 и 8 [7, 8]. В частности, случаи ИСИ, вызванные emm28, часто регистрируются в Испании, Франции, Португалии и Финляндии. В то же время в других регионах мира преобладают иные emm-типы СГА, ассоциированные c ИСИ. Так, в Канаде наиболее часто инвазивные инфекции вызывали штаммы СГА emm-типов 1, 4 и 12 [9], на Тайване – emm11, 102 и 106 [10], в Индии – emm12, 30 и 48 [11]. В США при инвазивной СГА-инфекции увеличивается частота встречаемости штаммов emm-типа 59 [12]. Во многих странах при некротическом фасциите и синдроме токсического шока выделяют штаммы СГА emm-типа 1 [13].
Недавно предложенная emm-кластерная система типирования СГА распределяет emm-типы в 48 функциональных кластеров, содержащих близкородственные М-белки [3]. Новая система типирования СГА может использоваться для анализа особенностей в характеристике СГА в том или ином регионе с высоким уровнем заболеваемости СГА и большим разнообразием циркулирующих emm-типов. Находит подтверждение идея сдвига парадигмы от типоспецифического иммунитета к emm-кластерному, что открывает новые возможности для разработки вакцин против СГА-инфекции.
В данном исследовании наибольшее количество культур (в том числе emm169 и 88) принадлежало одному кластеру (Е4), что встречается и в других регионах мира [14]. В то же время кластер А-С4 (emm12), широко распространенный почти повсеместно, был представлен только одним инвазивным штаммом (см. табл. 1). Обнаруженные нами штаммы по своим emm-типам принадлежали к 9 emm-кластерам, и 3 штамма относились к не входящим ни в какой кластер отдельным emm-типам (clade Y).
Одним из преобладающих типов СГА, вызывающим ИСИ, был emm-тип 28, наиболее характерный для Европы. Штаммы emm-типа 28 выделяли в основном у молодых людей, что подтверждает наличие у возбудителей особых свойств, обеспечивающих штаммам этого типа повышенную вирулентность [15]. Выделенные нами штаммы типа emm28 отличались от описанных ранее отсутствием резистентности к макролидам и ряду других антибиотиков. Они представляют собой разные клоны, отличающиеся, в частности, по наличию или отсутствию гена speA (см. табл. 1).
На сегодня нет однозначного ответа, с чем в первую очередь связаны инвазивные свойства штаммов – с определенными emm-типами или наличием определенных профагов/профаговых генов. По данным ряда авторов, наличие эритрогенного токсина А, кодируемого бактериофаговым геном speA, является одним из маркеров агрессивности штамма. Однако в данном исследовании ген speA был обнаружен у небольшой части инвазивных штаммов (см. табл. 1). Мониторинг молекулярно-генетических свойств выделенных штаммов дал основание допустить наличие эпидемической связи между случаями ИСИ, вызванными одним и тем же типом (emm64.0) и характеризующимися идентичным набором фаговых генов, не характерным для других штаммов [16].
Несмотря на сохраняющуюся высокую чувствительность СГА к препаратам пенициллинового ряда in vitro, их применение не всегда оправдано, что связано не только со случаями аллергических реакций, но и с локализацией части стрептококков внутри клеток хозяина [17]. В связи с этим при стрептококковых инфекциях часто применяют антибиотики-макролиды, а при ИСИ рекомендовано применение клиндамицина. В нашем исследовании был выявлен значительный процент культур, резистентных к макролидам (эритромицину, азитромицину и кларитромицину). Поскольку встречаются полирезистентные штаммы СГА, что особенно важно, нечувствительные к клиндамицину (см. табл. 2), заслуживает внимания тот факт, что среди исследованных нами штаммов резистентность к хлорамфениколу не встречалась одновременно с резистентностью к клиндамицину.
В связи с тем, что при ИСИ происходит быстрое распространение стрептококков в тканях с последующим их разрушением, чрезвычайно важно оперативно выявить наличие или отсутствие СГА как этиологического агента. Простота манипуляций при использовании экспрессной тест-системы позволяет проводить анализ при подозрении на СГА-этиологию инфекции в ходе операции. Отсутствие ложноположительных и ложноотрицательных результатов при использовании экспресс-теста, их совпадение с результатами, полученными классическим микробиологическим методом, ставит вопрос о расширении сферы их применения.
Таким образом, анализ распространенности штаммов СГА при инфекциях мягких тканей в одном из московских стационаров показал многообразие выделяемых генотипов в Москве и их высокую изменчивость. Генотипирование помогает устанавливать эпидемические связи между отдельными случаями ИСИ. Несмотря на то что для более точной оценки вирулентного потенциала штамма необходимы дополнительные данные, обнаружение так называемых инвазивных emm-типов дает предварительную информацию о возможной угрозе развития ИСИ. Выявление полирезистентных штаммов СГА указывает на необходимость мониторинга чувствительности выделяемых культур к антибиотикам. Использование методов экспресс-диагностики при СГА-инфекциях мягких тканей позволит обеспечить своевременное адекватное лечение, что предотвратит развитие инвазивной инфекции, в ряде случаев заканчивающейся летальным исходом.


