3.1. Общие принципы лечения больных ВИЧ-инфекцией
Лекарственная терапия ВИЧ-инфекции включает в себя базисную терапию, а также терапию вторичных и сопутствующих заболеваний. Под базисной терапией понимают терапию, назначение которой определяется стадией и фазой заболевания, а также значением лабораторных маркеров прогрессирования ВИЧ-инфекции (количество CD4+-лимфоцитов и уровень РНК ВИЧ). Базисная терапия включает АРТ и химиопрофилактику вторичных заболеваний.
3.2. Антиретровирусная терапия (АРТ)
В настоящее время основным компонентом лечения больных ВИЧ-инфекцией является АРТ, с помощью которой можно добиться контролируемого течения заболевания, то есть состояния, при котором, несмотря на невозможность полного излечения, удается остановить прогрессирование болезни, предотвратить развитие вторичных заболеваний или добиться их регресса (если вторичные заболевания уже успели развиться), предотвратить потерю трудоспособности (или восстановить ее), увеличить продолжительность жизни пациента, снизить его контагиозность.
АРТ основана на назначении пациенту препаратов, подавляющих размножение ВИЧ. Такие препараты называются противоретровирусными (антиретровирусными).
Основной целью АРТ является увеличение продолжительности и сохранение качества жизни пациентов.
Дополнительными целями являются:
- снижение контагиозности пациента, что приводит к снижению риска передачи ВИЧ-инфекции (при половых контактах; от инфицированной ВИЧ женщины ребенку во время беременности, родов и в послеродовом периоде; от ВИЧ-инфицированного пациента медицинским работникам при возникновении аварийной ситуации во время оказания пациенту медицинской помощи);
- уменьшение финансовых затрат, связанных с госпитализацией, лечением вторичных заболеваний, нетрудоспособностью пациента;
- снижение демографических потерь, связанных со снижением репродуктивной способности и сокращением репродуктивного периода жизни.
Основной задачей АРТ, позволяющей добиться этих целей, является максимальное подавление размножения ВИЧ, что выражается в снижении ВН до неопределяемого уровня. При этом если для достижения противоэпидемического эффекта (незаразности пациента) достаточно снижения уровня РНК ВИЧ в крови < 1000 копий/мл, то для предотвращения развития резистентности уровень РНК ВИЧ должен быть снижен до максимально низкого, по крайней мере, до уровня ниже порога определения тест-систем с порогом 50 копий/мл.
Подавление репликации ВИЧ останавливает гибель CD4+-лимфоцитов, что приводит к восстановлению их популяции (рост количества CD4+-лимфоцитов в среднем на 100 клеток/мкл в год) и функциональной активности. Восстановление иммунитета ведет к предотвращению развития вторичных заболеваний, а если они уже развились – к их исчезновению. Это, в свою очередь, улучшает качество жизни пациента, сохраняет или восстанавливает его трудоспособность, предотвращает преждевременную смерть. Снижение содержания вирусов в крови, сперме, влагалищных выделениях снижает контагиозность пациентов. Кроме того, эффективное подавление размножения ВИЧ снижает вероятность развития мутаций, приводящих к возникновению штаммов, резистентных к терапии.
К принципам АРТ можно отнести:
- добровольность – осознанное участие пациента в принятии решения о начале лечения и его проведении, основанное на понимании преимуществ АРТ и связанных с ней проблем, выраженное информированным согласием;
- своевременность – как можно более раннее начало АРТ, особенно при выявлении неотложных показаний к ней;
- адекватность – тщательный выбор лекарственных препаратов с подбором оптимального для данного конкретного пациента их сочетания на основании существующих рекомендаций;
- непрерывность – постоянный прием антиретровирусных препаратов.
3.2.1. Показания для начала АРТ у взрослых и подростков
Традиционно показания к назначению АРТ больным ВИЧ-инфекцией основывались на:
- наличии клинической симптоматики вторичных заболеваний, которая свидетельствует о наличии иммунодефицита и отражается в стадии и фазе ВИЧ-инфекции по Российской классификации ВИЧ-инфекции (клинические показания);
- снижении количества CD4+-лимфоцитов в крови (иммунологические показания);
- наличии и выраженности репликации ВИЧ, оцениваемой по уровню РНК ВИЧ в плазме крови (вирусологические показания).
В настоящее время показанием к назначению АРТ является само наличие ВИЧ-инфекции у пациента. То есть АРТ рекомендуется назначать всем больным ВИЧ-инфекцией, независимо от наличия клинических проявлений (строгая рекомендация, средний уровень доказательности).
В приоритетном и неотложном порядке АРТ надо назначать (строгая рекомендация, высокий уровень доказательности):
- пациентам со стадиями заболевания 2В, 4 и 5 (пацентам с вторичными заболеваниями), независимо от количества CD4+-лимфоцитов и РНК ВИЧ в крови;
- пациентам с количеством CD4+-лимфоцитов < 350 клеток/мкл вне зависимости от стадии и фазы болезни;
- беременным.
Также в приоритетном порядке АРТ рекомендуется назначать (строгая рекомендация, средний уровень доказательности):
- пациентам с ВН > 100 000 копий/мл;
- женщинам, планирующим беременность;
- пациентам старше 50 лет;
- больным ХГС;
- больным с хроническим заболеванием почек;
- больным ХГВ;
- больным, перенесшим туберкулез;
- больным с нарушениями познавательной деятельности (когнитивными расстройствами);
- пациентам с выраженной анемией или тромбоцитопенией, если они являются проявлениями ВИЧ-инфекции;
- пациентам с заболеваниями, требующими длительного применения терапии, угнетающей иммунитет (лучевая терапия, кортикостероидные гормоны, цитостатики);
- инфицированному ВИЧ партнеру, имеющему постоянного ВИЧ-негативного партнера, при условии предварительного консультирования обоих;
- при подготовке ВИЧ-инфицированного пациента к применению вспомогательных репродуктивных технологий.
3.2.2. Действия при выявлении показаний к АРТ
Период от выявления показаний к АРТ до ее начала должен быть максимально сокращен. При уровне CD4+-лимфоцитов < 200 клеток/мкл он не должен превышать 2 нед. Поэтому консультационную работу по подготовке пациента к лечению необходимо начинать при первой же консультации лечащего врача и продолжать ее при каждой последующей.
При выявлении показаний к проведению АРТ проводится дополнительное обследование больного, в результате которого необходимо решить следующие задачи:
1. Получить исходные данные о состоянии пациента, необходимые для последующей оценки эффективности проводимой терапии (критерии эффективности).
2. Выявить возможные противопоказания к тем или иным антиретровирусным препаратам или факторы риска их применения, а также исходные данные, которые позволят оценивать безопасность проводимой терапии (критерии безопасности).
3. Подобрать оптимальную для данного конкретного пациента схему АРТ. Прием антиретровирусных препаратов можно начинать до того, как будут окончательно установлены стадия и фаза заболевания и получены результаты исследования, не связанные с определением безопасности АРТ.
Лечение проводится на добровольной основе и предполагает активное участие самого больного. Поэтому важнейшим компонентом успеха АРТ является психологическая подготовка пациента, неотъемлемая часть которой – консультирование по вопросам приверженности к лечению и рисков нарушения ее эффективности, его предполагаемой эффективности, противопоказаний и осложнений планируемой терапии. Женщинам детородного возраста сообщают о возможном влиянии проводимого лечения на течение беременности и развитие плода. Вся информация должна быть представлена больному не только в устном, но и в письменном виде.
Перед назначением лечения необходимо получить письменное информированное согласие пациента.
Обследование, проводимое с целью выявления возможных противопоказаний к терапии и ее компонентам (так называемые тесты безопасности), на основании которых подбирается оптимальная для пациента схема АРТ и в дальнейшем оценивается безопасность лечения, включает в себя:
- осмотр лечащим врачом (включая консультирование, сбор анамнеза, полное физикальное обследование, выявление сопутствующих заболеваний, регистрацию сопутствующей терапии);
- регистрацию вторичных заболеваний и определение динамики их течения;
- определение индекса качества жизни;
- рентгенографию органов грудной клетки (если ее не проводили в течение последних 6 мес.);
- консультацию невролога (при назначении d4T или ddI);
- для женщин – консультацию гинеколога (если ее не проводили в течение последних 6 мес.);
- общий анализ крови (гемоглобин, гематокрит, тромбоциты, эритроциты, лейкоциты и лейкоцитарная формула);
- биохимический анализ крови (общий белок, холестерин, креатинин, АЛТ, АСТ, ЩФ, ЛДГ, билирубин и его фракции, КФК, амилаза или липаза, глюкоза);
- общий анализ мочи;
- исследование на генетическую предрасположенность к гиперчувствительности к АВС – определение HLA B*5701, если ее не проводили ранее (невозможность проведения теста не является абсолютным противопоказанием для назначения АВС);
- тестирование тропизма ВИЧ к CCR5-рецепторам (в России доступен генотипический тест), если предполагается назначить его ингибиторы (MVC);
- для женщин детородного возраста – экспресс-тест на беременность (не менее чем за 3 дня до начала лечения), если предполагается назначать EFV или другие препараты, назначение которых при беременности не рекомендуется.
Другие исследования можно проводить при наличии дополнительных показаний, в частности, учитывая особенности отдельных препаратов (спектр побочных эффектов, лекарственные взаимодействия, определение рецепторов чувствительности и т. д.).
Поскольку весь комплекс исследований может занять длительное время, часть их можно провести уже после начала приема антиретровирусных препаратов. Также можно начать терапию, не дожидаясь получения результатов некоторых исследований, материалы для которых, тем не менее, должны быть взяты до начала лечения. Например, результаты исследования ВН не влияют на выбор терапии (за исключением случаев, когда предполагается назначить схему, содержащую АВС или RPV). Эти результаты нужны для оценки эффективности терапии и представляют ценность лишь в сравнении с исследованием, проведенным уже на фоне лечения (как минимум через 1 мес. после его начала).
Однако исследования, непосредственно влияющие на выбор эффективной и безопасной для пациента схемы АРТ, должны быть проведены до начала лечения. К ним относятся общий и биохимический (по крайней мере, определение уровней АЛТ, АСТ, креатинина или мочевины) анализы крови.
При назначении некоторых препаратов рекомендуется иметь результаты и других тестов, позволяющих оценить их потенциальную эффективность и безопасность.
К таким исследованиям можно отнести:
- при назначении EFV женщине, способной к деторождению – экспресс-тест на беременность;
- при назначении TDF – общий анализ мочи и определение уровня креатинина в сыворотке крови (расчет скорости клубочковой филитрации);
- при назначении АВС и содержащих его препаратов – исследование на HLA B*5701 и уровень РНК ВИЧ в сыворотке крови;
- при назначении MVC – исследование на тропность вируса к CCR5-рецепторам;
- при назначении RPV – исследование на уровень РНК ВИЧ в сыворотке крови.
Отсутствие возможности проведения этих исследований не должно быть причиной задержки назначения АРТ, так как практически всегда возможен подбор альтернативного препарата.
3.2.3. Антиретровирусные препараты
Антиретровирусные (противоретровирусные) препараты нацелены на уязвимые этапы жизненного цикла ВИЧ и тем самым препятствуют его размножению. В настоящее время уже создано и внедрено в клиническую практику достаточно много таких препаратов. Создаются и испытываются новые препараты. Однако все они лишь подавляют размножение ВИЧ и не способны уничтожить генетический материал вируса, интегрированный в ДНК клетки хозяина. Они не способны привести к элиминации вируса из организма, то есть к полному излечению от ВИЧ-инфекции.
В мировой клинической практике применяют следующие группы антиретровирусных препаратов (перечисляются в порядке внедрения в клиническую практику).
1. Нуклеозидные ингибиторы обратной транскриптазы (НИОТ) ВИЧ блокируют процесс обратной транскрипции (синтез вирусной ДНК на матрице вирусной РНК). Представляют собой измененные молекулы нуклеозидов или нуклеотидов (отсюда и название – нуклеозидные аналоги), встраивающиеся в синтезируемую цепочку ДНК и прекращающие ее дальнейшую сборку.
2. Ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ) блокируют необходимый для осуществления обратной транскрипции вирусный фермент – обратную транскриптазу ВИЧ.
3. Ингибиторы протеазы (ИП) – препараты, блокирующие процесс формирования полноценных белков ВИЧ и, в конечном итоге, сборку новых вирусов.
4. Препараты, воздействующие на рецепторы, используемые вирусом для проникновения ВИЧ в клетку хозяина (ингибиторы фузии или слияния и ингибиторы хемокиновых рецепторов – CCR5).
5. Препараты, блокирующие процесс встраивания провирусной ДНК в ДНК человека с помощью фермента ВИЧ – интегразы – ингибиторы интегразы (ИИ) ВИЧ.
В России разрешено к применению 26 антиретровирусных препаратов (не считая дженериков и лекарственных форм, содержащих в себе несколько препаратов, называемых также препаратами с фиксированной комбинацией доз), в том числе 8 ингибиторов обратной транскриптазы ВИЧ из группы НИОТ (абакавир, диданозин, зидовудин, ламивудин, ставудин, тенофовир, фосфазид, эмтрицитабин), 5 – из группы ННИОТ (невирапин, рилпивирин, элсульфавирин, этравирин, эфавиренз), 9 – из группы ИП ВИЧ (атазанавир, дарунавир, индинавир, лопинавир, нелфинавир, ритонавир, саквинавир, типранавир, фосампренавир), 1 ингибитор слияния (энфувиртид), 1 ингибитор CCR5-рецепторов (маравирок) и 2 ИИ ВИЧ (долутегравир и ралтегравир).
3.2.4. Схемы АРТ (характеристика и принципы составления)
В настоящее время АРТ проводится по схемам так называемой высокоактивной антиретровирусной терапии (ВААРТ), когда пациенту одновременно назначают не менее трех антиретровирусных препаратов. При этом лечение проводится пожизненно, за исключением превентивной терапии (химиопрофилактики), проводимой после эпидемически значимого контакта с больным ВИЧ-инфекцией или инфицированным ВИЧ материалом. Ранее, когда существовали антиретровирусные препараты только группы НИОТ, АРТ проводили по схемам монотерапии (одним препаратом) или битерапии (двумя препаратами). Поскольку монотерапия и битерапия кардинально уступают ВААРТ в эффективности, в настоящее время эти схемы не применяются. Исключение составляют назначаемые с целью упрощения АРТ монотерапия ИП/r или битерапия ИП/r + НИОТ или ИП/r + ИИ, однако они принципиально отличаются от ранее применяемых схем битерапии, поскольку включают в себя препараты разных групп.
3.2.4.1. Последовательность назначения схем АРТ
Выделяют схемы АРТ первого, второго и т. д. ряда (линии) и схемы резерва (схемы спасения).
Под схемами первого ряда понимают схемы, назначаемые пациентам, которые ранее не получали АРТ или у которых АРТ возобновляется после перерыва (причем ранее получаемая схема осталась эффективной до момента ее прерывания). Также к схемам первого ряда относятся схемы, измененные вследствие развития побочных эффектов.
Под схемами второго ряда подразумевают режимы АРТ, применяемые в случае неэффективности схем первого ряда. Этим они отличаются от схем, которые назначают особым категориям больных или при непереносимости ранее получаемой схемы. Соответственно схемы третьего ряда назначают при неэффективности схем второго ряда.
Схемы резерва (схемы спасения) – нестандартные схемы, которые применяются при неэффективности схем второго и последующих рядов. Обычно они включают в себя препараты разных групп, подбор которых осуществляется индивидуально, исходя из анализа результатов исследования резистентности возбудителя и ранее проводимой терапии.
3.2.4.2. Приоритетность выбора схем АРТ
Различают предпочтительные, альтернативные и приемлемые схемы АРТ. В качестве предпочтительных и альтернативных используют схемы с доказанной вирусологической эффективностью, безопасностью и хорошей переносимостью.
Предпочтительные – схемы, оптимальные по совокупности параметров: эффективность, безопасность (наименьшая вероятность развития угрожающих жизни побочных эффектов), переносимость (наименьшая частота развития побочных эффектов), удобство приема, экономичность, в том числе для отдельных групп пациентов.
Альтернативные – схемы, уступающие предпочтительным по какому-либо параметру, или менее изученные.
Приемлемые – схемы, эффективность которых менее изучена, или нежелательные явления выражены в большей степени по сравнению с предпочтительными или альтернативными схемами.
При выборе схемы лечения для конкретного пациента с позиции «общественного здравоохранения» рекомендуется сначала рассматривать возможность назначения пациенту наиболее экономичной из предпочтительных для него схем. Если имеются данные, свидетельствующие о том, что альтернативная схема будет для данного пациента более эффективной, безопасной или переносимой (то есть пациент относится к одной из особых групп), назначают альтернативную схему. Альтернативные схемы назначают также пациентам, у которых развилась непереносимость приоритетной схемы. Приемлемые схемы могут применяться только при невозможности (например, из-за непереносимости) назначения предпочтительных и альтернативных схем.
3.2.4.3. Антиретровирусные препараты и их сочетания, не рекомендуемые для проведения АРТ
1. Любая монотерапия, за исключением бустированных ИП (см. приемлемые схемы), из-за низкой эффективности и высокой вероятности развития резистентности.
2. Любая битерапия из-за низкой эффективности и высокой вероятности развития резистентности, за исключением схем АРТ, приведенных в приемлемых режимах.
3. Тритерапия препаратами из группы НИОТ из-за низкой эффективности и высокой вероятности развития резистентности, за исключением комбинации ZDV + 3TC + ABC, применяемой в качестве альтернативной схемы у больных ВИЧ-инфекцией и туберкулезом при исходном уровне РНК ВИЧ < 100 000 копий/мл, или комбинации ZDV + 3TC + TDF (С3).
4. Любое сочетание аналогов одного нуклеозида, которые конкурируют при фосфорилировании и в результате снижают эффективность друг друга. Например, ZDV, d4T и Ф-АЗТ (все препараты являются аналогами тимидина) или 3ТС и FTC (препараты являются аналогами цитидина).
5. d4T + ddI (повышение токсичности и риск развития угрожающих жизни осложнений, в особенности во время беременности).
6. TDF + ddI (в дозе 400 мг) – значительное повышение токсичности ddI, снижение иммунологической эффективности терапии.
7. EFV + NVP или ETR (повышение токсичности).
8. NVP – женщинам при количестве CD4+-лимфоцитов > 250 клеток/мкл, мужчинам – > 400 клеток/мкл (повышенная вероятность развития гепатотоксичности как проявления реакции гиперчувствительности).
9. ETR + «неусиленные» RTV ИП (ETR снижает концентрации ИП).
10. ETR + некоторые «усиленные» RTV ИП (ATV/r, FPV/r – ETR снижает их концентрации).
11. IDV + ATV (повышение токсичности).
12. DRV, SQV и DRV без «усиления» RTV (из-за низкой эффективности и высокой вероятности развития резистентности).
13. Небустированный ATV с TDF (возможно снижение эффективности).
14. АВС и RPV при ВН > 100 000 копий/мл.
3.2.5. Оценка эффективности АРТ
3.2.5.1. Критерии, используемые для оценки эффективности АРТ
Для оценки эффективности АРТ используют клинические и лабораторные критерии.
Клинические критерии – оценка прогрессирования ВИЧ-инфекции и течения вторичных заболеваний – являются наиболее доступными показателями клинической эффективности лечения для практического врача и, в долгосрочном плане, наиболее объективными. Однако при краткосрочном наблюдении они недостаточно достоверны из-за характерной для ВИЧ-инфекции медленной динамики заболевания, невозможности быстрого восстановления угнетенного иммунитета. Кроме того, обострение течения имеющихся у больного вторичных заболеваний или появление новых после начала АРТ может быть проявлением синдрома восстановления иммунной системы. Особенно это характерно для пациентов с количеством CD4+-лимфоцитов < 50 клеток/мкл. Поэтому признаки клинического прогрессирования ВИЧ-инфекцией на фоне АРТ в течение первых 12 нед. ее проведения обычно не рассматривается как признак ее неадекватности.
Из лабораторных критериев оценки эффективности лечения наиболее информативным в настоящее время считается определение в крови уровня CD4+-лимфоцитов и ВН.
В России для определения ВН используется в основном метод ПЦР.
ВН считается наиболее, а клиническая динамика – наименее достоверным показателем эффективности АРТ. Если эти критерии не соответствуют друг другу, надо ориентироваться на результаты исследования ВН, а при отсутствии возможности такого исследования – на изменение количества CD4+-лимфоцитов.
3.2.5.2. Ожидаемый эффект АРТ
При хорошем эффекте АРТ уже к 4–8-й неделе после начала лечения ожидается снижение уровня РНК ВИЧ приблизительно в 10 раз (то есть на 1 log10), к 12–16-й неделе – ниже 400 копий/мл, а через 24 нед. – ниже 50 копий/мл (ниже уровня определения) (А1). К этому же сроку (12–24-я нед.) можно ожидать и повышения уровня CD4+-лимфоцитов. В дальнейшем уровень РНК ВИЧ должен быть ниже уровня определения, но возможны разовые подъемы, не превышающие 1000 копий/мл; ожидается повышение уровня CD4+-лимфоцитов в среднем на 5–10 клеток/мкл в 4 нед. (В1). По мере повышения уровня CD4+-лимфоцитов происходит регресс вторичных заболеваний (если они были).
Однако у части пациентов АРТ не столь удачна. У 10–30% из них в течение полугода не удается снизить ВН ниже 50 копий/мл.
3.2.5.3. Факторы, способствующие неудаче АРТ
Факторы, способствующие неудаче АРТ, многообразны:
- высокий уровень ВН, низкий уровень СD4+-лимфоцитов, наличие тяжелых вторичных заболеваний при начале лечения;
- изначальная резистентность вируса к применяемым препаратам;
- неадекватная предшествующая терапия;
- нарушение режима приема лекарств (из-за недостаточной приверженности к лечению, развития побочных реакций на прием препаратов, несоблюдения пищевого режима);
- неправильное назначение терапии (неподходящая для пациента схема лечения, плохое консультирование по режиму приема препаратов и т. д.);
- сопутствующий прием лекарств, снижающих эффективность какого-либо из компонентов АРТ.
3.2.5.4. Критерии неэффективности АРТ
АРТ считается недостаточно эффективной (или потерявшей эффективность) в следующих случаях:
- появление новых или рецидив ранее отмечавшихся вторичных заболеваний (не ранее чем через 12 нед. после начала лечения) (С2);
- отсутствие повышения количества CD4+-лимфоцитов более чем на 50 клеток/мкл в течение 1 года лечения (В2);
- снижение количества CD4+-лимфоцитов ниже уровня, отмеченного до начала АРТ (В1);
- снижение количества CD4+-лимфоцитов более чем на 50% ниже пикового уровня, достигнутого в ходе лечения (В2);
- отсутствие снижения уровня РНК ВИЧ в сыворотке крови ниже 400 копий/мл (2,6 log10) через 12–16 нед. или 50 копий/мл (1,7 log10) через 24 нед. после начала лечения (А1);
- повышение ВН до уровня > 1000 копий/мл (3,0 log10) в двух повторных исследованиях, если до этого был достигнут неопределяемый уровень (А1).
Количество CD4+-лимфоцитов и уровень РНК ВИЧ не учитывают как достоверные, если эти исследования проведены менее чем через 4 нед. после перенесенных инфекционных заболеваний или вакцинации.
При получении лабораторных результатов, свидетельствующих о неэффективности терапии, для их подтверждения исследование следует повторить с интервалом не менее 4 нед.
3.2.5.5. Действия при выявлении неэффективности АРТ
Если неэффективность терапии подтверждается, проводят анализ возможных причин неудачи. Чаще всего она связана с нарушением режима приема препаратов. Поэтому сначала следует исключить причины, не связанные с устойчивостью вируса к принимаемым препаратам.
Необходимо обратить внимание на следующие моменты:
- соблюдение пациентом режима приема препаратов (отсутствие пропусков, соблюдение дозировок, регулярность приема);
- соблюдение предписанного для данной схемы лечения пищевого режима;
- не принимает ли пациент лекарственных препаратов (или психоактивных веществ), влияющих на метаболизм какого-либо из компонентов АРТ или усиливающих ее побочные эффекты.
Если выясняется, что нарушения режима приема или несоблюдение пищевого режима связаны с недисциплинированностью пациента, с ним проводят работу с целью повышения приверженности к терапии. При необходимости к ней привлекают специалиста, имеющего соответствующую подготовку. Возможно назначение более удобного для пациента режима приема препаратов (например, 2, а не 3 раза в день; назначение препаратов, прием которых не зависит от приема пищи).
Если нарушение режима приема препаратов связано с побочными эффектами, для их коррекции следует назначить патогенетическую или симптоматическую терапию. Возможно проведение дополнительного обследования с целью выявления сопутствующих заболеваний (гепатиты, панкреатит и т. д.) или вредных привычек (прием алкоголя, курение), способствующих появлению побочных эффектов. Проводится лечение сопутствующих заболеваний. При незначительных побочных эффектах, вероятно ухудшающих качество жизни пациента, но не угрожающих его здоровью, или при наличии вредных привычек проводят дополнительное консультирование пациента с целью повышения приверженности к терапии. Возможна замена плохо переносимого препарата.
Если причиной неудачи является сопутствующая терапия, проводят коррекцию либо ее, либо схемы АРТ.
Если выясняется, что неудача терапии не связана с вышеперечисленными причинами, рекомендуется смена схемы АРТ.
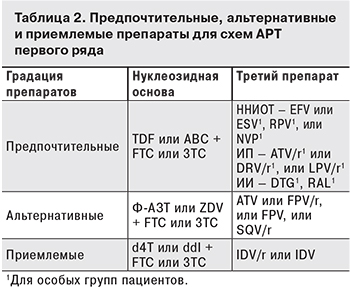 3.2.6. АРТ первого ряда
3.2.6. АРТ первого ряда
Схема АРТ первого ряда – схема, которая не менялась по причине неэффективности. Пациент, возобновляющий ранее прерванную эффективную терапию или сменивший схему лечения из-за ее непереносимости, все равно будет считаться получающим терапию первого ряда.
В приведенных ниже схемах лечения препараты перечисляются в алфавитном порядке (если специально не оговорено их перечисление в порядке приоритетности).
3.2.6.1. Предпочтительные и альтернативные схемы АРТ первого ряда
Стандартная схема АРТ включает 2 НИОТ и третий препарат, которым может быть ННИОТ, ИП или ИП/r, ИИ (табл. 2).
При использовании сочетаний АВС +3 ТС, TDF + FTC, ZDV + 3ТС для удобства пациентов, повышения приверженности и, как следствие, эффективности рекомендуется назначать комбинированные формы препаратов: ABC/ЗТС (600 мг + 300 мг) 1 раз в сутки, TDF/FTC (300 + 200 мг) 1 раз в сутки, ZDV/ЗТС (300 +150 мг) 2 раза в сутки.
3.2.7. Схемы АРТ, рекомендуемые особым группам пациентов
Для некоторых категорий пациентов рекомендуются конкретные схемы АРТ, поскольку для них эти схемы являются оптимальными (наиболее эффективными, безопасными или переносимыми).
К таким особым категориям относятся:
1. Пациенты с анемией, эритропенией или гранулоцитопенией.
2. Женщины детородного возраста, не исключающие рождение ребенка на фоне АРТ.
3. Беременные.
4. Пациенты с низким (< 50 клеток/мкл) уровнем CD4+-лимфоцитов.
5. Пациенты старше 50 лет или имеющие нарушения липидного или углеводного обмена.
6. Пациенты с нейрокогнитивными расстройствами.
7. Пациенты, имеющие повышенный уровень аминотрансфераз.
8. Пациенты, получающие лечение ХГС.
9. Пациенты с ХГВ.
10. Пациенты с туберкулезом.
11. Пациенты, страдающие хроническими заболеваниями почек.
12. Пациенты, инфицированные ВИЧ-2.
3.2.7.1. Пациенты с анемией, эритропенией или гранулоцитопенией
Наличие анемии и/или гранулоцитопении является ограничением для назначения ZDV и содержащих его препаратов. Этим пациентам вместо ZDV при умеренной анемии или гранулоцитопении (уровень гемоглобина > 95 г/л или количество эритроцитов меньше нормы, или количество нейтрофилов > 1000 клеток/мкл) рекомендуется назначать Ф-АЗТ или ABC, или TDF, а при более выраженной анемии или гранулоцитопении – АВС или TDF (перечислено в алфавитном порядке). При невозможности использования вышеперечисленных препаратов могут быть назначены d4T или ddI.
Вторым препаратом в нуклеозидной основе схемы АРТ остаются 3TC или FTC.
Выбор третьего препарата проводится на общих основаниях.
Действия в случае развития анемии и эритропении описаны в приложении 4.
3.2.7.2. Женщины, у которых на фоне АРТ не исключены беременность и рождение ребенка
Женщинам, у которых на фоне АРТ не исключены беременность и рождение ребенка, при подборе оптимальной схемы АРТ рекомендуется назначать препараты, наиболее безопасные для плода или беременной. В первую очередь следует избегать назначения EFV – препарата, возможно, обладающего тератогенным действием.
Рекомендуемые схемы АРТ:
- при количестве CD4+-лимфоцитов от 50 до 250 клеток/мкл и нормальном уровне АЛТ и АСТ – NVP в сочетании с Ф-АЗТ или АВС, или TDF, или ZDV + 3ТС, или FTC;
- при любом количестве CD4+-лимфоцитов – ATV/r или LPV/r в сочетании с Ф-АЗТ или АВС, или TDF, или ZDV + 3ТС, или FTC.
В качестве альтернативных препаратов можно назначать DRV/r или SQV/r, а при невозможности их назначения – другие ИП. Как приемлемые НИОТ могут назначаться d4T и ddI, но не в сочетании друг с другом.
3.2.7.3. Беременные
Рекомендуемые схемы АРТ: ATV/r или LPV/r в сочетании с ZDV/3TC или Ф-АЗТ + 3ТС.
При назначении АРТ беременным предпочтение отдается препаратам с доказанной безопасностью для плода и беременной и с хорошо изученной фармакокинетикой у беременных.
В качестве третьего компонента схемы АРТ предпочтительными являются ATV/r в стандартной дозе, которая не меняется на протяжении всей беременности, или LPV/r в таблетках (400/100 мг 2 раза в сутки, а в III триместре – 600/150 мг 2 раза в сутки) (А1).
При непереносимости LPV/r или ATV/r можно использовать (в порядке приоритетности) DRV/r, SQV/r, NVP (при количестве CD4+-лимфоцитов < 250 клеток/мкл и нормальном уровне АЛТ и АСТ), EFV (только при сроке беременности более 13 нед.). Если применение ни одного из этих препаратов невозможно, могут использоваться другие бустированные ИП. Частота назначения всех ИП (за исключением ATV/r) – не реже 2 раз в сутки.
В качестве нуклеозидной основы рекомендуется ZDV/3TC или Ф-АЗТ + 3ТС. При наличии анемии, эритропении или гранулоцитопении проводится коррекция терапии, как описано в разделе «Пациенты с анемией, эритропенией и гранулоцитопенией». Не рекомендуется применять при беременности сочетание d4T с ddI из-за высокого риска развития лактоацидоза (А4).
Применение EFV не рекомендуется в I триместрe беременности, так как он может оказать токсическое действие на плод. Также не рекомендуется применение небустированных ИП (эффективность может быть недостаточна). Если беременность наступила на фоне приема EFV или небустированного ИП, их следует заменить препаратом, рекомендуемым для применения у беременных.
Если беременность наступила на фоне уже проводимой терапии с использованием DRV/r, SQV/r, NVP, АВС, TDF, проводить замену этих препаратов не рекомендуется.
При назначении и проведении АРТ у беременных следует опираться на руководства и протоколы по профилактике передачи ВИЧ от матери ребенку.
3.2.7.4. Пациенты с исходно низким (< 50 клеток/мкл) количеством CD4+-лимфоцитов
Рекомендуемые схемы АРТ: ATV/r или DRV/r, или LPV/r в сочетании с АВС (если ВН < 100 000 копий/мл), или TDF + 3TC, или FTC.
При использовании в схемах АРТ усиленных RTV ИП отмечено более быстрое и выраженное (по сравнению со схемой, включающей ННИОТ) увеличение количества CD4+-лимфоцитов. Также более быстрое восстановление уровня CD4+-лимфоцитов происходит при применении ABC в сравнении c ZDV (В2). Поэтому для лечения пациентов с низким уровнем CD4+-лимфоцитов рекомендуется применять схемы, включающие бустированный ИП. В качестве нуклеозидной основы рекомендуется применять комбинацию ABC с 3TC (предпочтительно комбинированный препарат ABC/3TC) или TDF с 3TC в стандартных дозах (или комбинированный препарат TDF/FTC). Однако у пациентов с ВН > 100 000 копий/ мл препараты, содержащие ABC, применять не рекомендуется (была показана меньшая эффективность АВС в сравнении с TDF при ВН > 100 000 копий/мл в схемах, содержащих EFV и ATV/r.)
3.2.7.5. Пациенты старше 50 лет или имеющие нарушения липидного и углеводного обмена, больные с риском сердечно-сосудистой патологии
Для этих пациентов в качестве нуклеозидной основы рекомендуются Ф-АЗТ или ZDV, или TDF (при отсутствии признаков нарушения минерализации костей и/или патологии почек).Применение ABC возможно у пациентов старше 50 лет в качестве альтернативы при отсутствии дополнительного риска сердечно-сосудистой патологии.
Выбор третьего препарата:
- препараты группы ННИОТ – ESV или NVP [при количестве CD4+-лимфоцитов от 50 до 250 клеток/мкл (для женщин) или от 50 до 400 клеток/мкл (для мужчин) и нормальном уровне активности АЛТ и/или АСТ], или RPV (при количестве CD4+-лимфоцитов > 200 клеток/мкл или ВН < 100 000 копий/мл). В качестве альтернтивы – EFV
или
- ATV (при количестве CD4+-лимфоцитов > 50 клеток/мкл),
или
- препараты группы ИИ.
В качестве альтернатив – ATV/r или DRV/r.
Больные с риском сердечно-сосудистой патологии нуждаются в назначении препаратов, в наименьшей степени влияющих на липидный и углеводный обмен.
Небустированный ATV, ИИ (RAL, DTG), ННИОТ (NVP, ESV, RPV и ETR), а также антагонист CCR5-рецепторов MVC в наименьшей степени влияют на углеводный и липидный обмен, поэтому указанные препараты оптимальны для этой группы пациентов. В наибольшей степени на углеводный и липидный обмен влияют бустированные RTV ИП.
При формировании нуклеозидной основы схемы АРТ у лиц старшего возраста необходимо учитывать, что 2 наиболее современных и малотоксичных препарата группы НИОТ – АВС и TDF – у этих пациентов должны применяться с осторожностью. Это связано с имеющимися данными о нефротоксичности TDF и его неблагоприятном влиянии на минерализацию костей, а также возможном повышении риска ИБС при применении АВС.
Действия в случае развития дислипидемии описаны в приложении 4.
При необходимости совместно с кардиологом назначают липидоснижаюшие препараты. Однако при их назначении необходимо учитывать совместимость с антиретровирусными препаратами (приложение 7).
При нарушении углеводного обмена ведение пациента осуществляется совместно с эндокринологом.
3.2.7.6. Пациенты с нарушениями познавательной деятельности (когнитивными расстройствами)
Основным критерием выбора препаратов для данной категории пациентов является способность препаратов хорошо проникать через гематоэнцефалический барьер.
Рекомендуемая схема АРТ:
LPV/r или DRV/r (1200/200 мг в сутки), или ИИ в сочетании с Ф-АЗТ или ZDV + 3TC. У пациентов с количеством СD4+-лимфоцитов от 50 до 250 клеток/мкл (для женщин) или 400 клеток/мкл (для мужчин) и нормальным уровнем трансаминаз предпочтительным препаратом может быть NVP.
Другие сочетания можно использовать в качестве альтернативных, при этом следует учитывать, что из препаратов группы НИОТ после ZDV наилучшим проникновением через гематоэнцефалический барьер обладают ABC и d4T.
Хорошим коэффициентом проникновения через гематоэнцефалический барьер обладают ИИ DTG (высокий уровень проникновения) и RAL (уровень проникновения выше среднего).
3.2.7.7. Пациенты с ВИЧ-2
Рекомендуемые схемы АРТ:
DRV/r, или LPV/r в сочетании с Ф-АЗТ или АВС, или TDF, или ZDV + 3TC или FTC.
В качестве альтернативы могут использоваться другие препараты групп ИП и НИОТ. Препараты группы ННИОТ на ВИЧ-2 не действуют. Действие препаратов других групп изучено недостаточно.
3.2.7.8. Пациенты с сочетанной инфекцией ВИЧ + ХГВ, (B+D)
Рекомендуемые схемы АРТ:
- при нормальном уровне активности АЛТ и/или АСТ или при повышении его не более чем в 2,5 раза выше верхней границы нормы (ВГН) – EFV или RPV в сочетании с TDF + (3TC или FTC);
- при наличии противопоказаний к назначению EFV или при уровне активности АЛТ и/или АСТ более чем в 2,5 раза выше ВГН – ИП/r или ИИ в сочетании с TDF + (3TC или FTC) (В1).
При подборе АРТ пациентам с ХГВ необходимо назначать препараты, обладающие наименьшей гепатотоксичностью.
Решающим фактором для выбора TDF, 3TC и FTC в схемах АРТ является их способность эффективно подавлять репликацию не только ВИЧ, но и ВГВ. Поэтому сочетание этих препаратов в стандартной дозировке используют в качестве нуклеозидной основы при лечении больных ВИЧ-инфекцией, сочетающейся с гепатитом В или В + D.
При развитии резистетности ВГВ к 3TC у пациентов, ранее получавших схему АРТ, не включавшую TDF, его необходимо назначить вместо другого НИОТ. В качестве альтернативы при невозможности назначения TDF дополнительно к АРТ рекомендуется назначение ETV в дозе 1 мг в сутки в качестве четвертого препарата (3TC при этом не отменяется).
Кроме того, у больных с сочетанием ВИЧ-инфекции и ХГВ при развитии почечной патологии возможна замена TDF другим препаратом из группы НИОТ и добавление ETV в дозе 1 мг в сутки для лечения ХГВ (В2).
При развитии резистентности ВИЧ к 3TC, но сохранении к нему чувствительности ВГВ, необходимо учитывать высокую вероятность обострения XГВ при замене 3ТС другим НИОТ, не активным в отношении ВГВ. При наличии мутации резистентности ВИЧ к 3ТС (M184V) следует сохранить препарат в составе схемы АРТ и добавить TDF.
Возможно использовать один из следующих альтернативных вариантов:
- подобрать препараты в схему АРТ на основе исследования резистентности ВИЧ, при этом в качестве четвертого препарата оставить 3ТС, к которому сохранена чувствительность ВГВ;
- в качестве четвертого препарата вместо 3ТС назначить телбивудин или ETV (В3).
Обострение гепатита В может наступить и при отмене TDF. Поэтому при развитии резистентности к этому препарату или его непереносимости следует заменить TDF на другой НИОТ и назначить другой препарат, подавляющий репликацию ВГВ (телбивудин или ETV). Если имеет место только резистентность ВИЧ к TDF, но его непереносимости нет, возможно сохранение TDF в схеме лечения с добавлением другого НИОТ, к которому ВИЧ сохранил чувствительность.
3.2.7.9. Пациенты с сочетанной инфекцией ВИЧ + ХГС
В настоящее время в качестве терапии ХГС применяют схемы, как правило, включающие препараты прямого противовирусного действия (ПППД).
При лечении пациентов с сочетанной инфекцией ВИЧ и ХГС необходимо учитывать несколько дополнительных факторов:
- меньшую эффективность лечения ХГС при низком количестве CD4+-лимфоцитов (при использовании ПегИФН и RBV);
- гепатотоксичность некоторых антиретровирусных препаратов;
- возможное негативное взаимодействие антиретровирусных препаратов с препаратами, применяемыми для лечения ХГС.
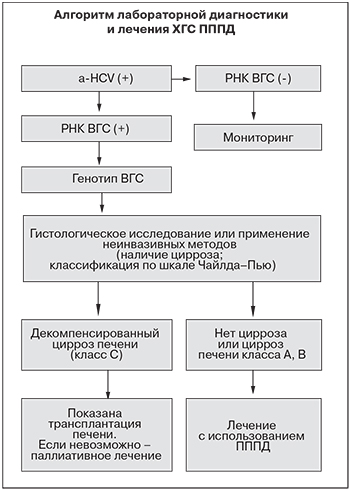
При уровне CD4+-лимфоцитов > 500 клеток/мкл можно начать с лечения ХГС, а после его завершения начать АРТ. При использовании схем терапии ХГС, включающих только ПППД, начало АРТ в большинстве случаев откладывается на 8–12 нед. При уровне CD4+-лимфоцитов < 500 клеток/мкл рекомендуется начать АРТ, к которой через несколько недель (после подавления репликации РНК ВИЧ) присоединить лечение ХГС. При наличии высокой степени активности гепатита С для уменьшения риска развития гепатотоксичности антиретровирусных препаратов возможно начать лечение с терапии ХГС с последующим назначением АРТ. При уровне CD4+-лимфоцитов 200–350 клеток/мкл лечение ХГС целесообразно проводить ПППД [симепревир (SMP); нарлапревир, бустированный ритонавиром (NVR/r)] в сочетании с комбинацией ПегИФН и RBV (для пациентов с ВГС генотипа 1), а больным с ВГС генотипов 2 и 3 – комбинацией ПегИФН и RBV, если ее польза превышает возможный риск. При количестве CD4+-лимфоцитов < 200 клеток/мкл и неопределяемом уровне РНК ВИЧ на фоне АРТ для терапии ХГС у больных ВИЧ-инфекцией следует использовать комбинации только ПППД. При количестве CD4+-лимфоцитов < 100 клеток/мкл (даже при неопределяемом уровне РНК ВИЧ на фоне АРТ) начало терапии ХГС целесообразно отложить до повышения количества CD4+-клеток. При очень низком количестве CD4+-лимфоцитов существует высокая вероятность развития вторичных заболеваний; кроме того, этим пациентам необходимо проводить химиопрофилактику ряда заболеваний (туберкулез, токсоплазмоз, пневмоцистоз, ЦМВ-инфекция и др.). Данная рекомендация основана на мнении экспертов (исследований эффективности и безопасности терапии ХГС у больных ВИЧ-инфекцией с очень низким количеством CD4+-лимфоцитов проведено не было). При наличии выраженного фиброза печени (> F3), высокой степени активности гепатита С решение о начале противовирусной терапии ХГС принимается индивидуально.
По состоянию на август 2018 г. на территории Российской Федерации зарегистрированы следующие ПППД для лечения ХГС:
1. ИП NS3/4A: боцепревир (BOC), телапревир (TVR), симепревир (SMP), асунапревир (ASV), паритапревир, бустированный ритонавиром (PTV/r); нарлапревир, бустированный ритонавиром (NVR/r); глекапревир (GCV); гразопревир (GZR).
2. Ингибиторы полимеразы NS5B – софосбувир (SOF, НИОТ), дасабувир (DSV, ННИОТ);
3. Ингибиторы комплекса NS5A – даклатасвир (DCV); омбитасвир (OMV), который применяется только в комбинации с PTV/r; пибрентасвир (PBV); элбасвир (EBR).
 Необходимо отметить, что ИП первой генерации (BOC и TVR) уже практически не используются и исключены из международных рекомендаций. В список ЖНВЛП включены SMP, NRV/r, DCV и комбинация «3D» (OBV/PTV/r + DSV). Поскольку комбинации OBV/PTV/r + DSV и NRV/r + ПегИФН + RBV включают ритонавир, то терапию ХГС больным ВИЧ-инфекцией следует проводить только на фоне АРТ.
Необходимо отметить, что ИП первой генерации (BOC и TVR) уже практически не используются и исключены из международных рекомендаций. В список ЖНВЛП включены SMP, NRV/r, DCV и комбинация «3D» (OBV/PTV/r + DSV). Поскольку комбинации OBV/PTV/r + DSV и NRV/r + ПегИФН + RBV включают ритонавир, то терапию ХГС больным ВИЧ-инфекцией следует проводить только на фоне АРТ.
На рисунке представлен алгоритм лабораторной диагностики и лечения ХГС с помощью ПППД.
Терапию ХГС препаратами SMP или NRV/r в сочетании с ПегИФН и RBV проводят в течение 12 нед. При наличии неопределяемого уровня РНК ВГС лечение продолжают еще 12 нед. только ПегИФН и RBV.
При неудаче терапии пациента с ХГС, вызванным ВГС генотипа 1, тройной комбинацией препаратов (SMP или NVR/r + ПегИФН + RBV) при отсутствии цирроза печени рекомендуется схема, включающая только ПППД (DCV + SOF или OBV/PTV/r + DSV, или GCV/PBV, или GZR/EBR), в течение 8–12 нед., а при наличии компенсированного цирроза печени – в течение12–24 нед.
Рекомендации по выбору схем противовирусной терапии ХГС представлены в табл. 3. Данные комбинации препаратов рекомендуются как для пациентов с ХГС, вызванным ВГС генотипа 1, ранее не получавших лечения ХГС, так и при предшествующей неудаче терапии ПегИФН и RBV.
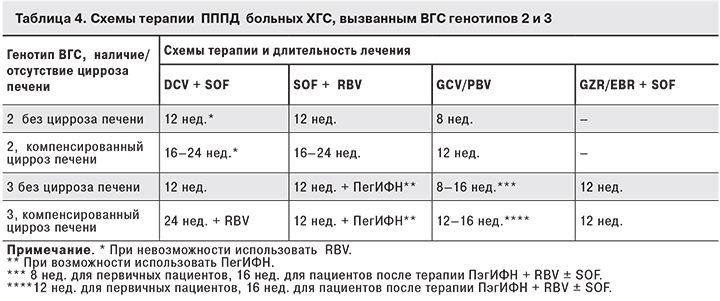
В табл. 4 представлены комбинации препаратов, рекомендованных как для пациентов с ХГС, вызванным ВГС генотипов 2 и 3, ранее не получавших лечения ХГС, так и для лиц с предшествующей неудачей терапии ПегИФН и RBV.

При неудаче терапии пациента с ХГС, вызванным ВГС генотипа 2, комбинацией ПегИФН + RBV при наличии компенсированного цирроза печени в качестве альтернативного режима рекомендуется схема SOF + RBV + ПегИФН в течение 12 нед. (при наличии способности принимать ПегИФН). При неудаче схемы SOF + RBV, вне зависимости от наличия или отсутствия компенсированного цирроза печени, рекомендуется схема GCV/PBV (в течение 8 нед. у пациентов без цирроза и 12 нед. у пациентов с циррозом) или SOF + RBV + ПегИФН в течение 12 нед. (при наличии способности принимать ПегИФН).
У больных ХГС, вызванным ВГС генотипа 3, при неэффективности лечения схемой ПегИФН + RBV и отсутствии цирроза печени рекомендуют DCV + SOF (12 нед.) или SOF + RBV + ПегИФН в течение 12 нед.(при наличии способности принимать ПегИФН). При наличии компенсированного цирроза печени – DCV + SOF (24 нед.) или SOF + RBV + ПегИФН в течение 12 нед. (при наличии способности принимать ПегИФН). Если пациент ранее получал лечение комбинацией SOF + RBV, то в качестве схемы 2-й линии рекомендуют DCV + SOF (24 нед.) или SOF + RBV + ПегИФН в течение 12 нед. (при наличии способности принимать ПегИФН), вне зависимости от наличия или отсутствия цирроза печени. У больных ХГС, вызванным ВГС генотипа 3, ранее получавших или не получавших лечения, высокоэффективной является комбинация GCV/PBV, применяемая в течение 8–16 нед. (при отсутствии цирроза печени) и 12–16 нед. – при наличии компенсированного цирроза печени.
После эффективного курса терапии ХГС и достижения устойчивого вирусологического ответа (24 нед. при использовании схем, включающих ПегИФН, и 12 нед. при применении ПППД) рекомендуется:
- при наличии фиброза печени > F3 для исключения гепатоцеллюлярной карциномы каждые 6 мес. проводить УЗИ печени и определять уровень альфа-фетопротеина;
- при наличии высокого риска повторного заражения ВГС (потребители инъекционных наркотиков, МСМ) ежегодно определять наличие РНК ВГС.
Пациентам с декомпенсированным циррозом печени (класс В или С), которым планируют или не планируют трансплантацию печени, включая больных с гепатоцеллюлярной карциномой, при ХГС, вызванным ВГС генотипов 1–3, рекомендуют схему DCV + SOF + RBV (600 мг) в течение 12 нед. При хорошей переносимости RBV суточная доза препарата может быть увеличена. У больных с ВГС генотипа 1 при непереносимости RBV можно использовать комбинацию SOF + DCV в течение 24 нед. Вместе с тем необходимо отметить, что согласно утвержденным на территории России инструкциям по применению препарата SOF (Sovaldi ®), использование его у больных с декомпенсированным циррозом печени противопоказано. Режим OBV/PTV/r + DSV, а также комбинация GZR/EBR противопоказаны больным с декомпенсированным циррозом печени (класс В и С). Комбинация GCV/PBV может применяться у больных с декомпенсированным циррозом печени класса В и противопоказана при циррозе класса С.
Пациентам с ХГС, по аналогии с пациентами с ХГВ, необходимо подбирать препараты, обладающие наименьшей гепатотоксичностью.
При назначении терапии ХГС препаратами интерферона (применяются ПегИФН) и RBV (15 мг/кг в сутки) необходимо учитывать лекарственные взаимодействия некоторых НИОТ с RBV.
 Не рекомендуется сочетание RBV с ZDV (увеличивается частота развития анемии) (В4), ddI (повышается вероятность декомпенсации заболевания печени) или d4T (повышается вероятность развития стеатоза печени) (С4). Следует также учитывать, что ABC и RBV являются производными одного нуклеозида и конкурируют в процессе фосфорилирования. Это не имеет клинического значения при назначении RBV в дозе не менее 13,6 мг/кг (стандартная терапевтическая доза), но при необходимости уменьшения дозы RBV потребуется изменение схемы АРТ (так как в меньщей дозе RBV будет уже недостаточно эффективен). При недостаточной приверженности к АРТ сочетание АВС с RBV теоретически может привести к ее неэффективности.
Не рекомендуется сочетание RBV с ZDV (увеличивается частота развития анемии) (В4), ddI (повышается вероятность декомпенсации заболевания печени) или d4T (повышается вероятность развития стеатоза печени) (С4). Следует также учитывать, что ABC и RBV являются производными одного нуклеозида и конкурируют в процессе фосфорилирования. Это не имеет клинического значения при назначении RBV в дозе не менее 13,6 мг/кг (стандартная терапевтическая доза), но при необходимости уменьшения дозы RBV потребуется изменение схемы АРТ (так как в меньщей дозе RBV будет уже недостаточно эффективен). При недостаточной приверженности к АРТ сочетание АВС с RBV теоретически может привести к ее неэффективности.
Оптимальным сочетанием НИОТ является TDF + 3TC (или FTC) в стандартных дозировках. При невозможности применять TDF назначают Ф-АЗТ или АВС (при уровне гемоглобина < 95 г/л – АВС) (В2).
Включение в состав схемы терапии ХГС ПППД также обусловливает выбор схемы АРТ (табл.5).
Стандартная схема АРТ для больных ВИЧ-инфекцией, сочетанной с ХГС, не получающих лечения ХГС ПегИФН-α2 и RBV:
- при нормальном или незначительно повышенном (не более чем в 2,5 раза выше ВГН) уровне активности АЛТ и/или АСТ – EFV или RPV (при наличии противопоказаний к назначению EFV) в сочетании с Ф-АЗТ или АВС, или TDF, или ZDV + 3TC.
- при более высоком уровне активности АЛТ и/или АСТ – ИП/r или ИИ в сочетании с Ф-АЗТ или АВС, или TDF, или ZDV + 3TC.
Стандартная схема АРТ для больных ВИЧ + ХГС, получающих лечение ХГС ПегИФН-α2 и RBV:
- при нормальном уровне активности АЛТ и/или АСТ или повышении его не более чем в 2,5 раза выше ВГН – EFV или RPV (при наличии противопоказаний к назначению EFV) в сочетании с Ф-АЗТ или АВС, или TDF + 3TC.
- при уровне активности АЛТ и/или АСТ более чем в 2,5 раза выше ВГН – ИП/r или ии в сочетании с Ф-АЗТ или АВС, или TDF + 3TC.
Для препарата NRV/r показано отсутствие лекарственных взаимодействий с препаратами RAL (вероятно, DTG), TDF, FTC (3TC). Поэтому при использовании комбинации NRV/r + ПегИФН + RBV целесообразно в схему АРТ включать TDF + FTC (3TC) + RAL.
Схему лечения ВИЧ-инфекции (без ущерба для эффективности АРТ) можно изменить на время применения ИП ВГС (12 нед. для SMP, NVR/r и GZR/EBR; 8–24 нед. для OВV/PTV/r; 8–16 нед. для GCV/PBV). ИП ВИЧ (кроме ATV в сочетании с OВV/PTV/r) можно на это время заменить на RAL или DTG (в сочетании с SMP или OВV/PTV/r или GCV/PBV, или GZR/EBR), или RPV (в сочетании с DСV или SMP, или GCV/PBV или GZR/EBR), или ETR.
При применении комбинации SOF + DCV можно не изменять схему АРТ, включающую ИП ВИЧ (кроме TPV/r).
При использовании в схеме АРТ препаратов группы ННИОТ (NVP, EFV, RPV или ESV) терапевтический режим следует изменить не менее чем за 1 нед. до начала терапии ХГС. После окончания лечения ИП ВГС можно вновь вернуться к исходной схеме АРТ.
Подходы к терапии острого гепатита С у больных ВИЧ-инфекцией точно такие же, как у больных моноинфекцией ВГС. После установления диагноза острого гепатита С через 4 нед. следует повторить определение РНК ВГС в плазме крови. Если уровень РНК ВГС не снизился или снизился < 2 lg10, следует начинать лечение. При снижении количества РНК ВГС > 2 lg10 определение уровня РНК ВГС следует повторить через 12 нед. Наличие РНК ВГС в плазме крови при повторном исследовании (через 12 нед.) является основанием для начала терапии. Пациентам с острым гепатитом С предпочтительно назначать схемы, включающие ПППД. Длительность курса терапии острого гепатита С препаратами ПППД в настоящее время обсуждается, и, по-видимому, должна составлять не менее 8–12 нед.
3.2.7.10. Пациенты с ВИЧ-инфекцией и циррозом печени
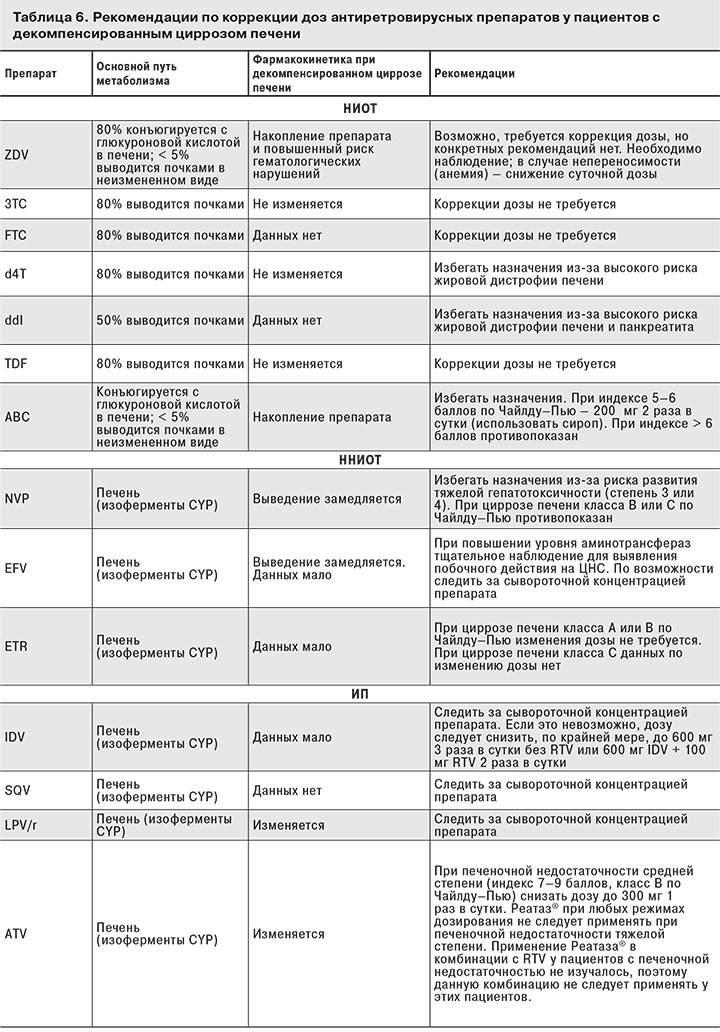
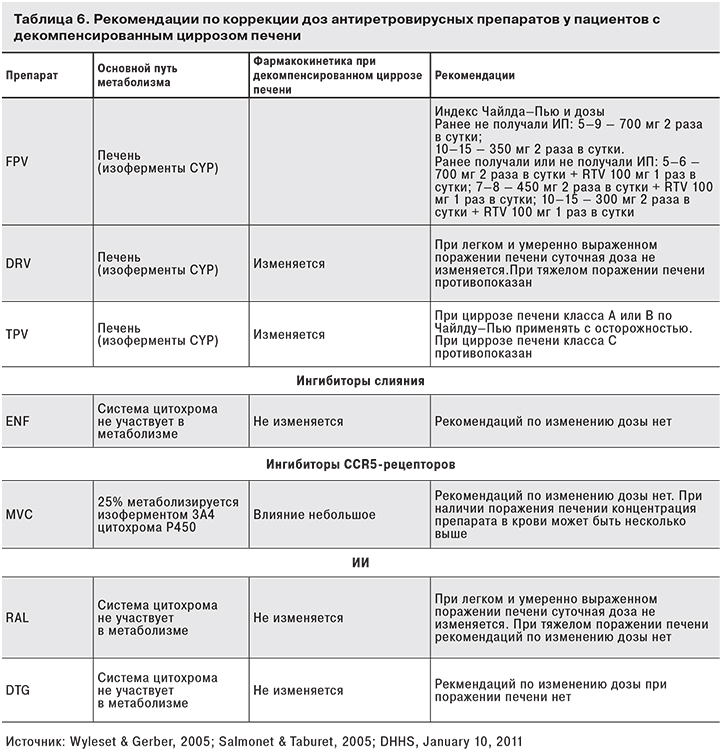
При декомпенсированном циррозе метаболизм антиретровирусных препаратов (ИП, ННИОТ), как и большинства других препаратов, метаболизм которых осуществляется в печени, ухудшается, поэтому во избежание риска их накопления необходимо снижать дозы ИП, ННИОТ, ZDV и ABC.
Информация о фармакокинетике антиретровирусных препаратов у больных с декомпенсированным циррозом печени и рекомендации по коррекции их доз у этой категории пациентов представлены в табл. 6.
3.2.7.11. Пациенты с ВИЧ-инфекцией и заболеваниями почек
У пациентов с патологией почек можно использовать предпочтительные схемы АРТ. Для оценки функции почек рекомендуется провести УЗИ почек, определить уровни креатинина и мочевины в крови, клиренс креатинина, белка в моче, глюкозы и фосфата в крови и моче. Клиренс креатинина рассчитывают по формуле Кокрофта–Голта для мужчин:
Для женщин полученный по этой формуле результат следует умножить на 0,85. Для расчета можно воспользоваться калькулятором, пройдя по ссылке htpp//tou.
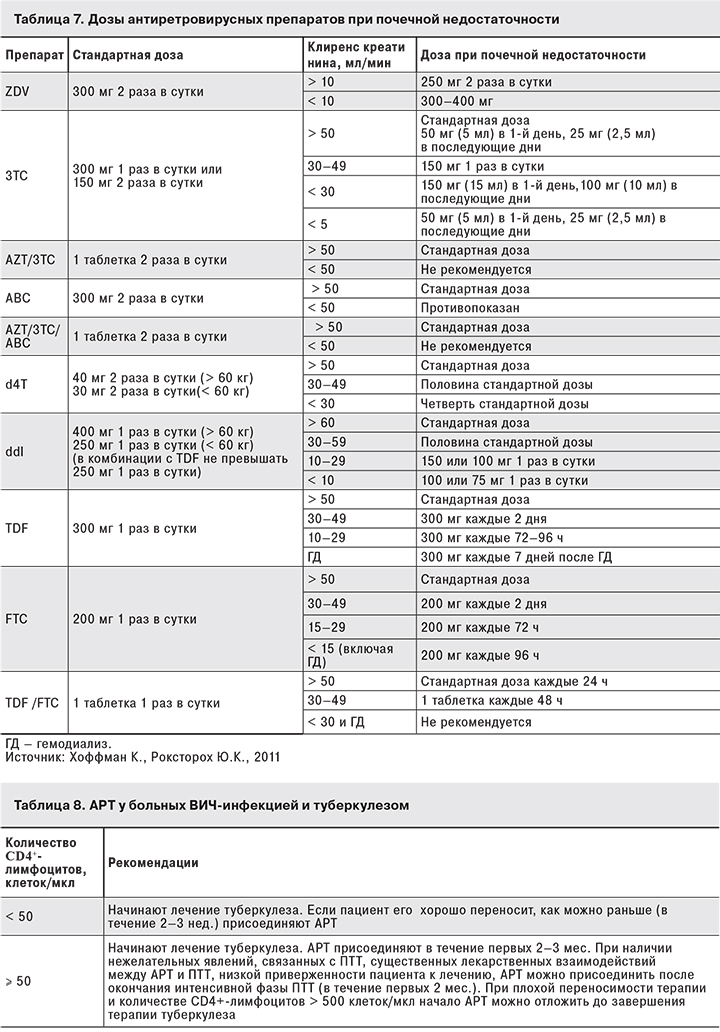
ТDF не рекомендуется больным с почечной недостаточностью. Его не следует назначать вместе с другими нефротоксичными препаратами. При применении IDV, ATV и, возможно, DRV существует повышенная вероятность развития почечнокаменной болезни. Препараты из групп ИП (кроме IDV) и ННИОТ практически полностью выводятся печенью, поэтому при почечной недостаточности у пациента необходимо корректировать суточную дозу только препаратов группы НИОТ (табл. 7).
В случае обнаружения белка в моче и/или снижении скорости клубочковой фильтрации < 60 мл/мин при повторном исследовании в течение 3 мес. показана консультация терапевта (нефролога), дополнительное обследование (приложение 6) и ведение пациента совместно с терапевтом или нефрологом.
3.2.7.12. Пациенты с ВИЧ-инфекцией и туберкулезом
Показания к назначению АРТ и основные ее принципы у больных с сочетанной патологией (ВИЧ-инфекция и туберкулез) практически не отличаются от рекомендаций для больных только ВИЧ-инфекцией. У больных ВИЧ-инфекцией и туберкулезом с низким (< 50 клеток/мкл) количеством CD4+-лимфоцитов задержка начала АРТ может привести к возникновению новых осложнений ВИЧ-инфекции и даже к смерти, поэтому таким пациентам рекомендуется не откладывать начало АРТ более чем на 2–3 нед. после начала противотуберкулезной терапии (ПТТ; табл. 8). При наличии менингита туберкулезной этиологии начало АРТ следует отложить до купирования явлений отека мозга и уменьшения признаков воспаления по результатам исследования ликвора (на 4–6 нед.).
Назначая лечение, следует учитывать, что при использовании в схемах ПТТ рифампицина рекомендуется предпочтительная схема АРТ первого ряда для лечения ВИЧ-инфекции у больных туберкулезом: EFV в сочетании с Ф-АЗТ или ABC, или TDF, или ZDV + 3TC, или FTC. Не рекомендуется одновременный прием рифампицина и ИП, RPV и ETR.
Альтернативные схемы
При исходном уровне РНК ВИЧ < 100 000 копий/мл возможно применение схемы АРТ, включающей 3 НИОТ.
1. ABC + ZDV + 3TC в стандартных дозировках (предпочтительно использовать комбинированный препарат ZDV/3TC/ABC – 1 таблетка 2 раза в сутки). У больных с уровнем РНК ВИЧ > 100 000 копий/мл эта схема менее эффективна, чем схема 2 НИОТ + ННИОТ (ZDV/3TC + EFV).
2. NVP 200 мг (1 таблетка) 1 раз в сутки в течение 14 дней, далее по 200 мг 2 раза в сутки + 2 НИОТ (ZDV и 3TC в стандартных дозировках). NVP не рекомендуется назначать женщинам при количестве CD4+-лимфоцитов > 250 клеток/мкл и мужчинам – > 400 клеток/мкл. Данную схему можно применять только при невозможности применения других схем, так как в сочетании с рифампицином уровень NVP в крови может быть ниже терапевтического; также возможно усиление гепатотоксичности препаратов.
3. RAL 800 мг (2 таблетки) 2 раза в сутки + 2 НИОТ.
4. DTG 50 мг (1 таблетка) 2 раза в сутки + 2 НИОТ.
5. MVC 600 мг 2 раза в сутки + 2 НИОТ.
При наличии туберкулезного менингита схему АРТ составляют с учетом индекса проникновения препаратов через гематоэнцефалический барьер (см. раздел 3.2.7.6.).При необходимости применения рифампицина в схеме ПТТ и отсутствии возможности использования других вариантов схемы АРТ (включающих 3 НИОТ, ННИОТ, ИИ или антагонист рецепторов CCR5) в качестве приемлемого режима пациенту может быть назначена схема АРТ, включающая 2 НИОТ + LPV/r в двойной суточной дозе (800/200 мг 2 раза в сутки) или LPV/r в стандартной суточной дозе (400/100 мг 2 раза в сутки) с добавлением RTV в дозе 300 мг 2 раза в сутки (С3).
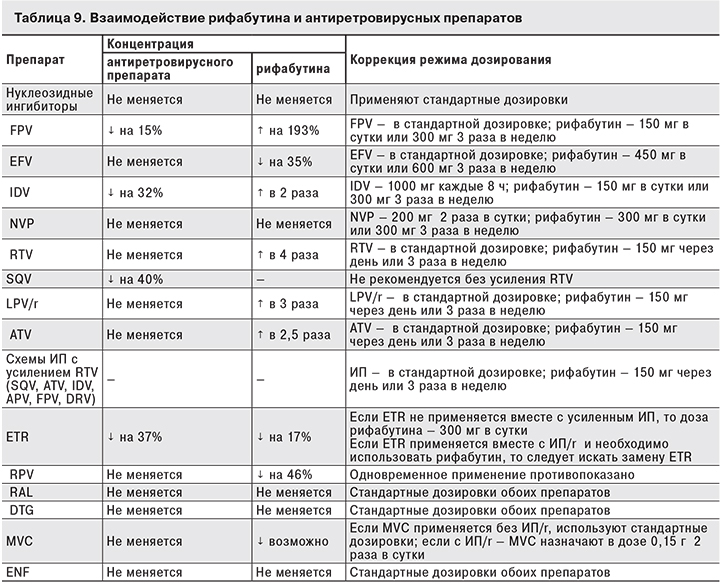
Противотуберкулезный препарат рифабутин можно использовать совместно со всеми ИП и со всеми ННИОТ (кроме RPV), а также с ИИ ВИЧ и препаратами, блокирующими присоединение ВИЧ к клетке. В некоторых случаях требуется коррекция дозы рифабутина или антиретровирусных препаратов (табл. 9).
3.2.7.13. Пациенты с нарушением функции глотания
В случаях, когда у взрослых, в том числе у беременных, применение таблетированных форм антиретровирусных препаратов затруднено и/или невозможно из-за:
- дисфагии функциональной, связанной с расстройством нервной системы;
- дисфагии органической, вызванной заболеваниями и поражениями ротоглотки или пищевода, в том числе кандидоза, язвы пищевода;
- нахождения пациента в отделении реанимации и палате интенсивной терапии;
- наличия у пациента гастростомы,
в качестве терапии следует использовать растворы и/или суспензии per os, либо вводить препараты через назогастральный зонд.
Антиретровирусные препараты, доступные к применению в форме раствора или суспензии – ABC, ZDV, 3TC, NVP.
LPV/r применяется в дозе 400/100 мг (5 мл раствора) 2 раза в день или 800/200 мг (10 мл раствора) 1 раз в день у пациентов с менее чем тремя мутациями, связанными с развитием резистентности к LPV.
3.2.8. Приемлемые схемы АРТ и режимы приема антиретровирусных препаратов
Приемлемыми считаются схемы АРТ или режимы приема отдельных антиретровирусных препаратов, которые по параметрам эффективности, переносимости, безопасности или изученности уступают альтернативным и, там более, приоритетным.
Приемлемые схемы могут применяться только при невозможности (например, из-за непереносимости) назначения предпочтительных и альтернативных схем.
К таким схемам относятся:
1. ddI 400 мг в сутки (250 мг в сутки при массе тела < 60 кг) + ЗТС + EFV или ИП/r, или ИИ RAL в стандартных дозировках (С2).
2. d4T 30 мг 2 раза в сутки (вне зависимости от массы тела) + ЗТС + EFV или ИП/r, или ИИ в стандартных дозировках (С1).
3. TDF (в стандартной дозировке) + ddI (250 мг в сутки вне зависимости от массы тела) + EFV или ИП/r, или ИИ в стандартных дозировках (С3). При сочетании TDF и ddI возможен недостаточный иммунологический ответ при наличии полного подавления репликации ВИЧ.
4. У больных туберкулезом с исходно низким (< 100 клеток/мкл) количеством CD4+-лимфоцитов в качестве четвертого препарата к схеме АРТ (2 НИОТ + ННИОТ или ИП) может быть добавлен ENF (90 мкг 2 раза в день подкожно в течение 6 мес.) (С3).
5. ННИОТ + ИП – EFV + LPV/r; ETR + DRV/r (В2).
6. ИП/r +ИИ – LPV/r + RAL или DRV/r + RAL (В2).
7. Монотерапия некоторыми ИП/r: LPV/r (2 раза в сутки); DRV/r (2 раза в сутки) без нуклеозидной основы (В2). Применение этой схемы возможно только для продолжения ВААРТ (РНК ВИЧ < 50 в мл в течение не менее 6 мес.) при невозможности продолжать лечение по схеме ВААРТ или с целью упрощения схемы лечения у пациентов с отсутствием коинфекции с ВГВ.
8. Битерапия ИП/r + НИОТ: LPV/r (2 раза в сутки) + 3TC; DRV/r (2 раза в сутки) + 3TC, ATV/r + 3TC (В2). Проведение терапии по такой схеме возможно только для продолжения АРТ при высокой эффективности схемы первой линии (полное подавление репликации РНК ВИЧ в течение не менее 6 мес. и повышение количества СD4+-лимфоцитов > 500 клеток/мкл) при невозможности продолжать лечение по схеме ВААРТ или с целью упрощения схемы лечения. Схемы ИП/r + 3ТС более прежпочтительны, чем схемы ИП/r.
9. Применение сниженной дозы EFV (400 мг в сутки) возможно у пациентов с плохой переносимостью стандартной дозы препарата, при условии хорошей приверженности к лечению и снижении ВН ВИЧ ниже определяемого уровня.
3.2.9. Изменение схемы АРТ
3.2.9.1. Изменение схемы АРТ при развитии непереносимости антиретровирусных препаратов
Для оценки безопасности проводимой терапии с целью ее своевременной коррекции в ходе лечения проводится плановое обследование согласно схеме, приведенной в разделе «Особенности диспансерного наблюдения при проведении АРТ». В случае возникновения нежелательных явлений (любые отклонения от нормы в состоянии больного, в том числе лабораторные, независимо от связи с проводимой терапией) проводятся внеплановые обследования с целью уточнения их связи с течением ВИЧ-инфекции и проводимой терапией.
При развитии непереносимости какого-либо из антиретровирусных препаратов схему АРТ изменяют в соответствии со спектром побочных явлений. При развитии непереносимости одного из компонентов АРТ сначала целесообразно попытаться провести корригирующие мероприятия, не изменяя дозы и схемы приема препаратов.
Целесообразно заменить не все препараты, а только то лекарственное средство, прием которого вызвал побочный эффект, с учетом механизма действия и спектра наиболее часто встречающихся токсических проявлений.
Если необходимость в отмене препарата, вызвавшего нежелательное явление, все же возникает, то для минимизации риска развития резистентности может быть рекомендована следующая тактика:
- при применении схем, содержащих 2 НИОТ + ИП или ИИ, возможно временное прерывание приема всех препаратов;
- при применении схем, содержащих 2 НИОТ + ННИОТ (если предполагается, что нежелательное явление связано именно с ННИОТ), целесообразно временно отменить только его, продолжив прием нуклеозидной основы не менее 1 нед.;
- если предполагается, что непереносимость связана с НИОТ, возможна временная отмена одного из препаратов нуклеозидной основы, только если в схеме АРТ присутствует ИП или DTG.
Необходимо учитывать и возможное взаимодействие с другими (не только антиретровирусными) препаратами, входящими в схему лечения. При этом нельзя забывать и о препаратах, которые больной в настоящее время не получает, но которые, возможно, будут ему вскоре назначены. В табл. 10 представлены варианты замены антиретровирусных препаратов при развитии нежелательных явлений.

Обследования, необходимые для предупреждения развития нежелательных явлений и их своевременного обнаружения, представлены в приложении 5.
3.2.9.2. Смена АРТ при недостаточной эффективности или потере эффективности ранее проводимого лечения
При неэффективности или потере эффективности ранее проводимой АРТ рекомендуется проведение теста на определение резистентности ВИЧ к антиретровирусным препаратам. Если проведение этого исследования невозможно, рекомендуется смена всех трех препаратов.
Если в составе схемы АРТ первого ряда пациент получал 2 НИОТ (ABC + 3TC или TDF + FTC или 3TC), то при вирусологической неэффективности лечения наиболее часто отмечают развитие мутации резистентности M184V (устойчивость вируса к FTC и 3TC). В таком случае сохраняется чувствительность вируса к ABC, ddI, d4T, а к ZDV, Ф-АЗТ и TDF даже повышается. В качестве 2 НИОТ второго ряда можно использовать сочетания ABC + ZDV или Ф-АЗТ, TDF + ZDV или Ф-АЗТ, ABC или TDF + ddI, ZDV или Ф-АЗТ + ddI. При сочетании TDF и ddI (суточная доза ddI – 0,25 г вне зависимости от массы тела) возможен недостаточный иммунологический ответ при полном подавлении репликации ВИЧ. При использовании в составе схемы АРТ второго ряда препаратов TDF, ZDV или Ф-АЗТ желательно не отменять 3ТС, поскольку при сохранении мутации M184V чувствительность вируса к этим препаратам возрастает.
Если пациент в составе стартового режима АРТ получал АВС + 3ТС, и при неэффективности лечения возникли мутации резистентности M184V + L74V (устойчивость вируса к АВС, ddI, 3TC, FTC), то в схемах второго ряда терапии можно применять комбинации TDF+ZDV, TDF+Ф-АЗТ.
При использовании в составе схем второго ряда сочетания TDF + FTC или 3TC и развитии неэффективности терапии вследствие возникновения мутаций K65R + M184V (резистентность вируса к TDF, d4T, ddI, 3TC, FTC), чувствительность вируса сохраняется только к ZDV и Ф-АЗТ. В таком случае схема АРТ второго ряда может включать 2 НИОТ (ZDV или Ф-АЗТ + 3ТС) + 1 ИП/r ± 1 ННИОТ.
Если пациент в составе стартового режима АРТ получал ZDV или Ф-АЗТ + 3ТС, и при неэффективности лечения возникли мутации резистентности M184V + ТАМ (мутации резистентности к тимидиновым аналогам), то выбор НИОТ второго ряда зависит от сочетания ТАМ-мутаций. При возникновении мутаций ТАМ-2 (D67N/G, K70K/R, K219H/Q) чувствительность вируса сохранена к TDF, ABC, которые можно сочетать с ddI. При развитии мутаций ТАМ-1 (M41M/L, L210L/W, T215T/N/S/Y) имеет место резистентность вируса ко всем препаратам класса НИОТ, поэтому схема АРТ второго ряда может содержать 1 ННИОТ + 1 ИП/r + 1 ИИ.
Если в первоначальной схеме использовался ННИОТ, его меняют на ИП или наоборот (А1).
Рекомендации по выбору третьего препарата в схеме АРТ второго ряда представлены в табл. 11.
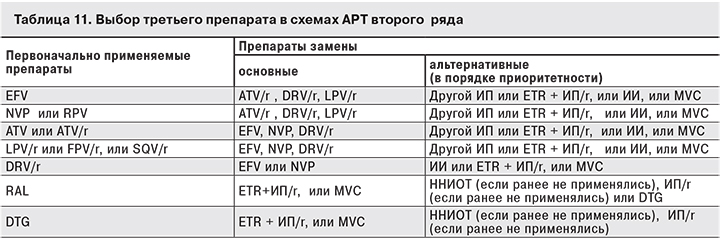
Препараты группы ИП используются в схемах второго и последующих рядов только в бустированном виде. Все они, кроме ATV/r, применяются не менее 2 раз в сутки. Существуют данные, что DRV/r в режиме 800/100 мг также может применяться однократно у пациентов, ранее получавших терапию и не имеющих мутаций, вызывающих резистентность к DRV.
Для оптимального выбора препаратов в схеме АРТ второго, третьего и последующих рядов целесообразно провести тест на определение резистентности ВИЧ к антиретровирусным препаратам (А1).
Исследование резистентности ВИЧ к антиретровирусным препаратам проводят:
- при выявлении вирусологической неэффективности АВТ, если нет других явных причин для нее (нарушение приема препарата, нарушение всасывания препарата, сопутствующие или недавно перенесенные инфекционные заболевания, недавняя вакцинация) (А1);
- перед началом АРТ больным ВИЧ-инфекцией, если известно, что заражение ВИЧ произошло от партнера с неэффективной АРТ (В2).
Нецелесообразно проведение теста на выявление резистентности ВИЧ к антиретровирусным препарам:
- после перевода пациента на новую схему АРТ (А4);
- при уровне ВН < 500 копий/мл (А4);
- через 4 нед. и более после отмены терапии (А4).
Если ВН находится в интервале от 500 до 1000 копий/ мл, существует вероятность того, что результат теста на анализ резистентности ВИЧ к антиретровирусным препаратам не будет достоверен (В1).
Если в результате исследования резистентности ВИЧ установлено, что устойчивость вируса развилась к конкретному препарату, рекомендуется замена именно этого лекарственного средства (А1).
При наличии в гене обратной транскриптазы ВИЧ мутации резистентности М184V (мутация устойчивости к ЗТС и FTC) снижаются способность вируса к размножению и риск развития резистентности к ZDV и TDF. Рекомендуется при выявлении мутации М184V оставлять 3ТС в схеме лечения (В2). При развитии этой мутации, но сохранении чувствительности к ZDV и/или TDF целесообразно включить в схему АРТ еще один препарат из группы НИОТ без отмены ЗТС.
Наибольшие сложности возникают при составлении схем АРТ третьего и последующих рядов, когда выбор эффективных препаратов существенно ограничен. В таких случаях, помимо оптимизации терапии, осуществляемой на основании результатов исследования резистентности, в схему АРТ целесообразно включать антиретровирусные препараты новых классов (ингибиторы слияния, ингибиторы рецепторов CCR5 и ИИ) или препараты известных классов, имеющие другой спектр резистентности, или их сочетание – то есть использовать схемы резерва (В1).
Задачей терапии больных, имеющих множественную резистентность ВИЧ к антиретровирусным препаратам, является снижение уровня РНК ВИЧ до неопределяемых значений с последующим увеличением количества CD4+-лимфоцитов. При адекватно подобраннной схеме АРТ даже у больных с множественной резистентностью ВИЧ к лекарственным препаратам уровень РНК ВИЧ должен быть < 400 копий/мл через 12–16 нед. и < 50 копий/мл через 24 нед. после изменения схемы терапии.
Оптимальный режим терапии выбирается с учетом индивидуальных особенностей, предшествующего опыта применения АРТ и теста на резистентность. У больных с множественной резистентностью ВИЧ к антиретровирусным препаратам оптимальным выбором терапии является включение в схему АРТ препаратов нового класса (ENF, MVC, ИИ) в сочетании с препаратами ранее применявшихся классов, обладающими другим спектром резистентности (DRV, TDF, ETR) (В1). Так, после неудачи АРТ, включавшей такие ИП, как ATV, ATV/r, FPV, FPV/r, IDV, IDV/r, LPV/r, SQV/r, применение DRV/r или TPV/r, с высокой долей вероятности, будет эффективным. Эффективность схемы АРТ, включающей ETR (после развития устойчивости ВИЧ к EFV или NVP), зависит от количества и спектра мутаций резистентности вируса. При возникновении > 2 мутаций резистентности ВИЧ эффективность терапии ETR снижается. Назначение ИИ DTG после неудачи схемы АРТ, содержавшей RAL, вследствие развития мутации Q148 в сочетании с 2 или более мутациями резистентности в значительной степени снижало эффективность новой схемы АРТ. После неудачи терапии RAL необходимо увеличивать дозу DTG (50 мг 2 раза в сутки) при его включении в схему АРТ.
3.2.9.3. Изменение схемы АРТ с целью ее оптимизации
Под оптимизацией понимается изменение эффективной и хорошо переносимой АРТ, чтобы сделать ее более подходящей для конкретного пациента. Одним из вариантов оптимизации является упрощение проводимой терапии.
Показаниями к оптимизации АРТ являются:
- большая лекарственная нагрузка (большое количество лекарственных форм, большая частота приема);
- прием устаревших препаратов;
- прием препаратов с высокой долговременной токсичностью;
- изменения (в том числе вероятные) состояния пациента, требующие коррекции терапии (беременность, пожилой возраст);
- появление заболеваний, на течение или лечение которых может неблагоприятно влиять проводимая АРТ;
- возможность назначения более экономичного режима АРТ;
- желание пациента получать более простой режим АРТ.
Для оптимизации АРТ может производиться замена как препаратов внутри одной группы, так и на препараты другой группы.
Внутригрупповая замена позволяет обойтись без применения препаратов из ранее не использовавшихся фармакологических групп, что сохраняет возможность их применения в будущем. Замена может производиться на более современные, более экономичные, менее токсичные препараты, лекарственные формы с меньшим числом принимаемых таблеток в сутки, меньшей кратностью приема, комбинированные препараты.
Внутри группы НИОТ возможна замена препаратов, переведенных из разряда приоритетных или альтернативных в приемлемые (d4T, ddI), на менее токсичные или замена ZDV у пациентов, получающих его более 2 лет, на ABC или TDF с целью снижения риска развития проявлений митохондриальной токсичности.
Внутри группы ННИОТ возможна замена NVP на EFV с целью перехода на прием препаратов 1 раз в сутки; замена EFV на NVP при планировании беременности или переходе пациента на режим работы, требующий активности в ночное время. Вариантом оптимизации терапии является замена EFV на ESV или RPV как с целью предотвращения развития нежелательных явлений, связанных с приемом EFV, так и с возможностью перехода на комбинированный препарат с суточной дозой в одной таблетке (RPV/TDF/FTC).
Внутри группы ИП возможна замена одного ИП другим, а также снижение кратности приема ИП, входящего в текущую схему терапии (например, переход с режима приема 2 раза в сутки на 1 раз в сутки, что возможно для LPV/r, DRV/r и FPV/r), или переход на небустированную форму (ATV/r на ATV).
Примерами оптимизации АРТ с переходом на препараты другой группы может быть упрощение терапии путем перехода с ИП/r на ННИОТ. Это можно делать и с целью удешевления терапии.
Возможным вариантом оптимизации АРТ является ее упрощение путем уменьшения количества активных препаратов в схеме терапии. Такой подход может применяться при лечении пациентов, находящихся на вирусологически эффективной АРТ на основе ИП/r. При этом АРТ может проводиться в виде битерапии ИП/r + 3TC (наименее токсичный из НИОТ), ИП + RAL.
Основным показанием для применения таких режимов является непереносимость или потенциальная непереносимость препаратов группы НИОТ. Условием назначения редуцированных схем является неопределяемый уровень ВН в течение не менее 6 мес. в сочетании с количеством CD4+-лимфоцитов > 500 клеток/мкл и отсутствие клинических проявлений вторичных заболеваний в течение последних 6 мес. При непереносимости пациентом всех препаратов группы НИОТ соблюдение этих условий необязательно.
Возможно применение следующих схем битерапии:
- ATV/r + 3TC;
- DRV/r + 3TC;
- LPV/r + 3TC;
- LPV/r + RAL;
- DRV/r + RAL.
Перед переходом на редуцированную схему АРТ необходимо проведение дополнительного консультирования пациента о необходимости соблюдения режима лечения. Через 1 и 3 мес. после перехода на редуцированную схему рекомендуется проведение исследования ВН. При сохранении ее на неопределяемом уровне в дальнейшем наблюдение можно проводить по обычному графику. При повышении ВН рассматривается вопрос о возвращении к полноценной схеме АРТ.
3.2.9.4. Прерывание АРТ
АРТ больным ВИЧ-инфекцией назначается пожизненно, и ее прерывание не рекомендуется, за исключением пациентов, получающих превентивную терапию (химиопрофилактику) после эпидемически значимого контакта с больным ВИЧ-инфекцией. Особенно неблагоприятны последствия прерывания терапии у беременных, детей до 5 лет, пациентов, находящихся в фазе прогрессирования стадий 4Б, 4В или с количеством СD4+-лимфоцитов ≤ 200 клеток/мкл, а также пациентов, у которых эффект АРТ (вирусологический, иммунологический и клинический) так и не был достигнут.
Тем не менее, на практике прерывание АРТ у больных ВИЧ-инфекцией иногда происходит, например, по решению пациента, при невозможности явиться для получении препаратов и т. д. Очень редко необходимость отмены антиретровирусных препаратов может быть связана с побочными проявлениями, особенно если они носят угрожающий жизни характер. Однако и в этом случае АРТ следует как можно быстрее возобновить, подобрав подходящую для данного пациента схему.
Временное прерывание всей схемы АРТ является для пациента более предпочтительным, чем ее продолжение в виде битерапии или нерегулярный прием препаратов. Исключение составляют схемы битерапии, описанные в разделе «Изменение схемы АРТ с целью ее оптимизации».
При прерывании терапии необходимо учитывать, что препараты из группы ННИОТ имеют период полувыведения, гораздо более длительный, чем применяемые вместе с ними препараты группы НИОТ, и низкий барьер резистентности. В результате после отмены АРТ ННИОТ в течение недели циркулируют в крови в режиме «монотерапии», что создает идеальные условия для селекции резистентных штаммов ВИЧ. При прерывании схем терапии, включающих ИП или ИИ, которые имеют период полувыведения, сопоставимый с НИОТ, такого не происходит. Поэтому тактика прерывания терапии у пациентов, получавших АРТ на базе ННИОТ, отличается от таковой при применении ИИ или ИП.
При отмене терапии, проводимой на основе ННИОТ, возможно несколько вариантов действия:
1. За месяц до отмены терапии заменить препарат из группы ННИОТ на ИП ВИЧ (в крайнем случае, можно использовать схему на основе ИП в течение 7–14 дней). Затем вся схема АРТ отменяется.
2. Если применение такой тактики невозможно, то после отмены ННИОТ следует продолжить прием 2 препаратов из группы НИОТ в течение 7–14 дней, после чего прервать терапию.
При прерывании АРТ, проводимой на основе ИП, следует одновременно отменить все антиретровирусные препараты.
С пациентами, прерывающими терапию, должно быть проведено консультирование, в ходе которого следует обсудить отрицательные (угроза прогрессирования ВИЧ-инфекции, повыщение риска передачи инфекции) и кажущиеся благоприятными («отдых» от лекарств) последствия этого шага. Должна быть разъяснена необходимость продолжения диспансерного наблюдения и его доступность для пациента, а также необходимость возобновления терапии.
За пациентами, прервавшими АРТ, необходимо продолжать диспансерное наблюдение в том же объеме, что и за получающими ее. При консультировании в процессе диспансерного наблюдения необходимо акцентировать внимание на необходимости возобновления АРТ, особенно в случаях снижения количества CD4+-лимфоцитов < 350 клеток/мкл или клинического прогрессирования болезни.
3.2.10. Отражение наблюдения за пациентом в амбулаторной карте (истории болезни)
Всеобщая доступность АРТ перевела ВИЧ-инфекцию из разряда заболеваний с неизбежным смертельным исходом в разряд заболеваний с контролируемым течением, при этом диспансерное наблюдение и лечение больных ВИЧ-инфекцией должно быть пожизненным. Вместе с тем нарушение режима наблюдения за пациентом и режима лечения, а также неверная интерпретация результатов лабораторных исследований и неадекватный выбор терапии могут иметь самые неблагоприятные последствия не только для здоровья пациента, но и для увеличения его значимости как источника инфекции.
Поэтому основные клинические и лабораторные маркеры прогрессирования ВИЧ-инфекции и эффективности АРТ должны быть четко отражены в амбулаторной карте.
Рекомендуется:
- в записях, производимых при первичном обследовании пациента и при плановых и внеочередных обследованиях, отражать уровень ВН и количество CD4+-лимфоцитов;
- у пациентов, получающих АРТ, отражать отклонения в результатах других лабораторных исследований, приуроченных к данному визиту, и давать их интерпретацию с точки зрения эффективности и безопасности АРТ;
- при назначении не приоритетной схемы АРТ формулировать обоснование выбора конкретной схемы.
Для облегчения и ускорения оценки динамики заболевания, эффективности и безопасности проводимой терапии и настоящего состояния пациента рекомендуется использовать лист-вкладыш «Развитие заболевания» (приложение 1).


