Токсин-корегулируемые пили (TCP) являются одним их ключевых факторов патогенности Vibrio cholerae, обеспечивающих колонизацию кишечника за счет адгезии микробных клеток к энтероцитам, а также образования микроколоний на начальных стадиях инфекции [1, 2]. В основном присутствие в геноме генов, ответственных за продукцию TCP (кластер tcpA-J в составе острова патогенности VPI), свойственно штаммам, несущим гены холерного токсина ctxAB в составе интегрированного в геном профага CTX. По наличию генов ctxA и tcpA (структурной единицы TCP) судят об эпидемической опасности того или иного штамма. Вместе с тем как на эндемичных, так и на неэндемичных по холере территориях из воды поверхностных водоемов, от больных и носителей периодически выделяются ctxAB-tcpA+-штаммы [3, 4]. Поскольку в настоящее время общеизвестна способность TCP служить рецептором для инфекционных вирионов CTXφ и играть таким образом важнейшую роль в его горизонтальной передаче [5], такие штаммы рассматриваются некоторыми авторами как «потенциально эпидемически опасные» на основании возможности их реверсии в токсигенные в результате специфической трансдукции [3, 6–8]. По всей видимости, данная точка зрения основана на гипотезе, предложенной S.M. Faruque и соавт. еще в 1998 г. [9], согласно которой ctxAB-tcpA+-штаммы, присутствующие в небольших количествах в объектах окружающей среды, при попадании в кишечник человека могут быть инфицированы фагом CTXφ и стать токсигенными. После размножения этих токсигенных клонов в кишечнике и выхода из организма хозяина их концентрация в водоемах возрастает, что и приводит к эпидемическим вспышкам холеры. Таким образом, указанные авторы полагали, что возникновение и селекция новых эпидемически опасных клонов в равной степени определяется факторами внутренней среды макроорганизма и внешней водной среды. К последним они относили оптимальную температуру воды, ее осмотические характеристики и влияние солнечного света, с которыми связывали сезонность вспышек на эндемичных территориях. Однако как в этой, так и в большинстве других публикаций, начиная с первого описания CTXφ [10], неоднократно подчеркивалось, что «традиционная» (TCP-зависимая) передача CTXφ вибрионам Эль-Тор происходит преимущественно in vivo, поскольку у представителей этого биовара (в отличие от классического) пили TCP почти не образуются вне организма хозяина, и в дальнейшем практически все авторы [5, 11 и др.] эксперименты по трансдукции проводили в основном в кишечнике мышей-сосунков. Отсюда следует, что для успешной реверсии нетоксигенных холерных вибрионов в токсигенные необходимо одновременное попадание в кишечник ctxAB-tcpA+-штамма и инфекционных вирионов CTXφ. Такая ситуация вполне реальна на эндемичных территориях, где в связи со слабо развитым санитарным обеспечением (либо его отсутствием) открытые водоемы достаточно часто контаминируются токсигенными штаммами, способными к выживанию в окружающей среде и к вирогении. При этом их концентрация должна быть достаточно высокой, поскольку размножение CTXφ происходит без лизиса клетки-хозяина, и число фаговых частиц обычно невелико, хотя и может заметно увеличиваться под действием солнечного света [12]. Напротив, в благополучных странах с умеренным климатом, в том числе и в России, где в последнее время отдельные случаи холеры являются исключительно завозными, а обнаружение токсигенных штаммов в объектах окружающей среды носит единичный характер, вероятность одновременного заражения людей ctxAB-tcpA+-штаммами и вирионами CTXφ крайне низка. Поэтому мы считаем нецелесообразным придавать ctxAB-tcpA+-штаммам, выделяемым в нашей стране, статус «потенциально эпидемически опасных».
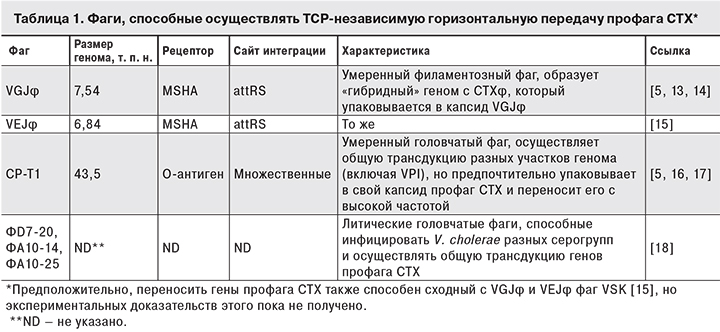
Другим аргументом в пользу нашей точки зрения является тот факт, что после обнаружения CTXφ было описано еще несколько фагов, успешно осуществляющих горизонтальный перенос генов ctxAB и всего профага CTX от токсигенных штаммов в клетки нетоксигенных, независимо от присутствия генов tcp-кластера. Как видно из табл. 1, фаг CP-T1 использует в качестве рецептора О-антиген, а рецепторами филаментозных фагов являются маннозо-чувствительные пили адгезии MSHA, которые, в отличие от TCP, образуются вибрионами во время пребывания в объектах окружающей среды [5].
Литические бактериофаги играют не только непосредственную [18], но и косвенную роль в горизонтальной передаче профага CTX, способствуя выходу из бактериальных клеток их геномной ДНК, которая может в присутствии хитина трансформироваться в другие клетки. Например, в опытах S.M. Udden и соавт. [19] штаммы серогруппы О141, содержащие CTX классического типа и неспособные образовывать инфекционные вирионы, успешно передавали профаг штаммам Эль-Тор в микрокосмах с хитиновым субстратом и О141-специфическим литическим бактериофагом JSF141B за счет трансформации, частота которой в 100 раз превышала таковую в отсутствие фага.
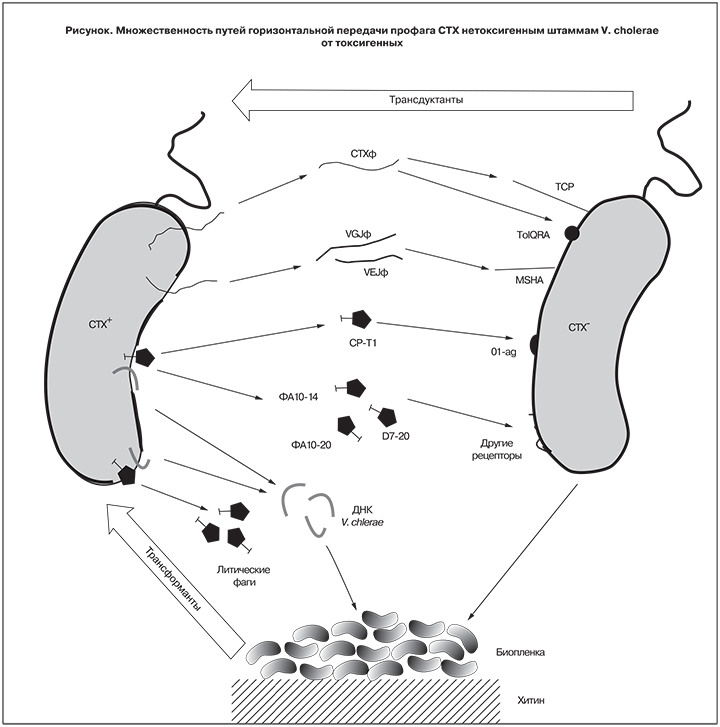
Наконец, CTXφ может инфицировать V. cholerae за счет взаимодействия с продуктами генов tolQRA [20], которые присутствуют у всех без исключения штаммов, поскольку их утрата приводит к резкому снижению жизнеспособности клеток, и такие мутанты, скорее всего, быстро погибают [21]. Несмотря на то что «нетрадиционная» (TCP-независимая) передача CTX может происходить вне организма человека, необходимым условием ее осуществления остается длительная циркуляция в объектах окружающей среды токсигенных штаммов-доноров инфекционных вирионов и/или геномной ДНК, что, как отмечено выше, не соответствует ситуации в России, где благодаря постоянному эпиднадзору и своевременным противоэпидемическим мероприятиям такие штаммы быстро элиминируются. Во всяком случае, мы ни разу не наблюдали повторного выделения токсигенных штаммов при последующих многократных исследованиях проб воды из мест их первичного обнаружения и других точек на той же территории [4].
В свете приведенных новых данных о множественности путей горизонтальной передачи CTX (см. рисунок) практически любой штамм может рассматриваться как «потенциально эпидемически опасный», и tcpA+ не обладают какими-либо существенными преимуществами, как реципенты этого профага.
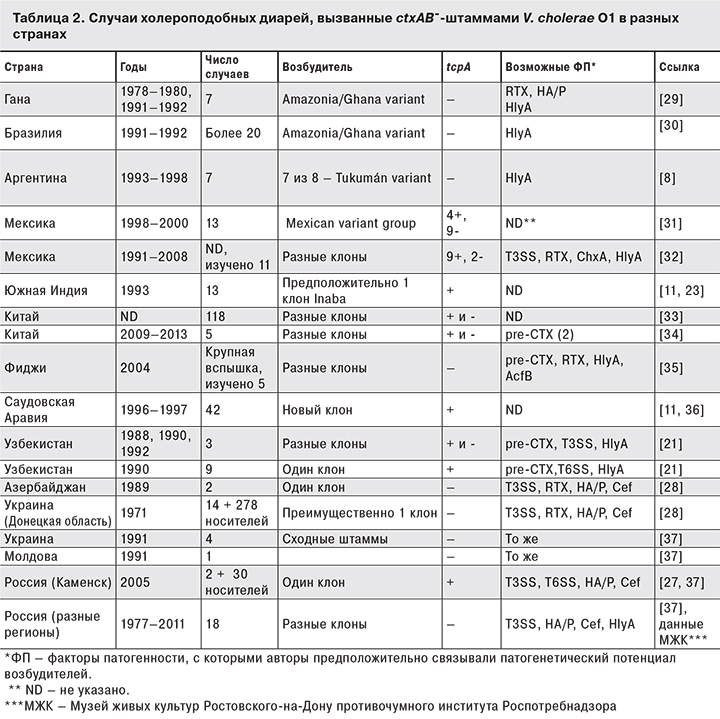
В то же время данное заключение ни в коей мере не умаляет значимости TCP как мощного фактора адгезии, обеспечивающего колонизацию кишечника, предшествующую продукции холерного и других токсинов. Тем не менее, являясь ключевым адгезином холерных вибрионов, TCP, по всей видимости, так же «взаимозаменяемы», как и прочие факторы патогенности [21]. Поскольку ctx+-штаммы за крайне редким исключением содержат и VPI c генами tcp, для иллюстрации этой «взаимозаменяемости» мы приводим результаты анализа литературных данных о случаях диарей, вызванных ctx--штаммами, содержащими и не содержащими ген tcpA (табл. 2). Следует отметить, что возбудители почти всех перечисленных в таблице случаев (за исключением носительства) были выделены от госпитализированных больных с клиническими проявлениями острых кишечных инфекций различной степени тяжести – от умеренных до неотличимых от таковых при типичной холере (в связи с чем в зарубежной литературе за ними закрепился термин «холероподобная диарея» [22–26 и др.]), которая не коррелировала с присутствием tcpA. Напротив, иногда прослеживались ситуации, когда tcpA+-штаммы вызывали менее серьезные осложнения, чем tcpA-+-штаммы. Например, вспышка 2007 г. в Каменском районе Ростовской области [27] по сути явилась «вспышкой носительства», что вполне могло быть связано с продукцией представителями вызвавшего ее клона TCP, хотя аналогичная вспышка 1971 г. в Донецкой области Украины с преобладанием носительства была вызвана tcpA--клоном [28]. С другой стороны, несколько крайне тяжелых спорадических случаев в Украине (1991) [21] были вызваны tcpA--штаммами. Лишь в одном из описанных случаев множественной заболеваемости за счет инфицирования tcpA+-клоном (Южная Индия, 1993) симптоматика не отличалась от холерной, однако обусловившие ее факторы не были идентифицированы [23].
По всей видимости, патогенетический потенциал каждого штамма зависит от эффективности экспрессии генов ряда факторов патогенности, присутствующих в их геномах в разных сочетаниях. К ним относятся кодируемые генами коровой области профага pre-CTX Cep (core encoded pilin), Ace (accessory cholera enterotoxin) и Zot (zonula occludens toxin); высокомолекулярный цитотоксин RTX (MARTX); гемолизин/цитолизин HlyA; контакт-зависимые системы секреции третьего и шестого типов (T3SS и T6SS); цитотонический фактор Cef; гемагглютинин/протеаза (HA/P), сериновая протеаза (продукт гена VC1649) [38]; дополнительный фактор колонизации AcfB (продукт гена acfB в составе VPI) [39]; возможно (но не доказано), также cholix-токсин (ChxA) [38, 40].
Происхождение ctxAB-tcpA+-штаммов холерных вибрионов, выделяемых в России, не поддается точному определению. Чаще всего их связывают с заносом с других территорий. Вместе с тем не исключено, что в определенные периоды времени они способны персистировать в водоемах, составляя «минорную» часть популяции, как это имеет место в эндемичных странах [9]. TCP могут играть определенную роль в этой персистенции, поскольку участвуют в образовании и дифференциации биопленок на хитиновых поверхностях водных членистоногих (ракообразных, личинок насекомых) [41], хотя и не являются единственными и незаменимыми участниками этого события. В присутствии хитина в биопленках, где существуют благоприятные условия для обмена генетической информацией [42], также возможно приобретение VPI ctxAB-tcpA- -штаммами за счет трансформации, а в планктонной фазе – за счет неспецифической трансдукции фагом CP-T1 [17]. Как подчеркивалось выше, этот процесс в наших условиях ограничен недостатком генетического материала для горизонтального переноса, однако его крайне низкая вероятность все же не равна нулю. С другой стороны, получены экспериментальные доказательства того, что ctxAB-tcpA+- штаммы могут возникать из ctxAB+tcpA+ вследствие утраты профага CTX во время пребывания в водной среде [43], а также в кишечнике [44]. На наш взгляд, формирование ctxAB-tcpA+-штаммов происходит обоими путями, и для ответа на вопрос об их происхождении в каждом конкретном случае необходимо использовать методы с высокой дискриминирующей силой, такие, например, как сравнительный VNTR-анализ [45].


