Цирроз печени (ЦП) – частая причина снижения и потери трудоспособности, а также летальности в молодом возрасте [1–5].
Наиболее частыми причинами развития ЦП являются хроническая интоксикация алкоголем (по разным данным, от 40–50 до 70–80%) и вирусные гепатиты (прежде всего гепатит С), а также неалкогольный стеатогепатит и аутоиммунные процессы (первичный билиарный ЦП) [1–3, 6].
В настоящее время большинство авторов признают, что алкогольно-вирусные ЦП относятся к наиболее быстро прогрессирующим вариантам заболевания, по показателям летальности они превосходят моноэтиологические формы в среднем на 50%. У больных этой группы наиболее часто развивается первичный рак печени [7–10].
Известно, что поражение ткани печени влияет на функцию системы регуляции агрегатного состояния крови, так как все факторы свертывания и фибринолиза в основном синтезируются в печени. Характер нарушений системы гемостаза при патологии печени сложен, касается всех звеньев гемостаза и часто непредсказуем. При хронических диффузных заболеваниях печени нередко наблюдается состояние гипокоагуляции крови в системном кровотоке с риском развития геморрагического синдрома и состояние гиперкоагуляции, что может привести к внутри- и внепеченочным тромбозам, легочной эмболии, портопульманарной гипертензии, спонтанному бактериальному асцит-перитониту [11–13].
В связи с этим целесообразно исследование гемостаза у больных ЦП различной этиологии.
Цель исследования – провести сравнительную характеристику показателей системы гемостаза у больных ЦП алкогольного генеза (ЦП-ХГА) и больных с ЦП микст-этиологии (ВГС + алкоголь; ЦП-ХГМ) класса В по Чайлду–Пью.
Материалы и методы
В течение 2011–2013 гг. на базе клинической инфекционной больницы № 2 г. Москвы проводилось комплексное обследование 26 больных ЦП класса В по Чайлду–Пью различной этиологии. Они были разделены на группы по этиологическому фактору: пациенты с ЦП-ХГА (n = 10) и пациенты с ЦП-ХГМ (n = 16). Степень печеночно-клеточной недостаточности при ЦП оценивали в соответствии с классификацией Чайлда–Пью.
Все исследования проводили в строгом соответствии с требованиями биомедицинской этики согласно Женевской конвенции о правах человека (1997) и Хельсинской декларации Всемирной медицинской ассоциации (2000) на основании разрешения локального этического комитета. В связи с этим у всех пациентов было получено письменное добровольное информированное согласие на участие в исследовании.
Критериями включения больных в исследование были возраст старше 18 лет, верифицированный диагноз ЦП в стадии декомпенсации класса В по Чайлду–Пью (согласно нормам, принятым ВОЗ). Кроме того, пациенты не употребляли наркотических средств последние 6 мес. и не получали противовирусной терапии.
Из исследования были исключены пациенты моложе 18 лет; имеющие сопутствующие гепатиты В (ГВ), D (ГD) или другие заболевания, вызывающие поражение печени, ВИЧ-инфекцию, туберкулез легких в анамнезе, аутоиммунные, онкологические заболевания, а также беременные женщины.
Все участники исследования с диагнозами ЦП-ХГА и ЦП-ХГМ заполняли опросник, который является международным официальным инструментом для определения алкогольной зависимости (Developed by Dr. John Ewing, founding Director of the Bowles Center for Alcohol Studies,University of North Carolina at Cahpel Hill). Общий балл по опроснику у всех больных был 2 или более, что свидетельствует о клинически значимом алкоголизме. Все пациенты были осмотрены психиатром-наркологом, который подтвердил хроническую алкогольную интоксикацию.
Были использованы общеклинические, биохимические и инструментальные методы исследования. Специфические маркеры гепатита С (ГС), ГВ и ГD выявляли методом твердофазного иммуноферментного анализа (ИФА). РНК ВГС в сыворотке крови определяли методом ПЦР с использованием тест-системы «АмплиСенс HCV-Монитор» («ИнтерЛабСервис», Россия), генотипирование ВГС проводили методом ПЦР с помощью коммерческой тест-системы «АмплиСенс HCV-генотип» («ИнтерЛабСервис», Россия). Определяли следующие показатели системы гемостаза: активированное частичное тромбопластиновое время (АЧТВ), международное нормализованное отношение (МНО), уровень фибриногена, тромбиновое время, агрегацию тромбоцитов (АТ) методом Борна, агрегацию эритроцитов (АЭ) по оригинальной методике Ю.А. Шереметьева, суммарную концентрацию нитратов и нитритов (NOx) методом Грисса с применением кадмиевого редуктора, активность фактора Виллебранда (ФВ), концентрацию Д-димеров (ДД).
С целью определения контрольных значений изучаемых параметров системы гемостаза было обследовано 30 практически здоровых лиц в возрасте от 25 до 45 лет, составивших контрольную группу, давших информированное согласие на обследование, не отличавшихся от больных по полу и возрасту; не имевших, по данным анамнеза и результатам биохимических и серологических исследований, вирусных гепатитов или других заболеваний печени.
Статистическую обработку результатов проводили с помощью лицензированных программ IBM SPSS Statistics 21.0 и статистического модуля программы Microsoft Excel 2010.
У больных ЦП все исследования проводили при поступлении в стационар и на 10–14-й день стационарного лечения.
Исследования и терапию всем пациентам проводили в инфекционной клинической больнице № 2 Департамента здравоохранения г. Москвы согласно стандартам оказания медицинской помощи.
Результаты и обсуждение
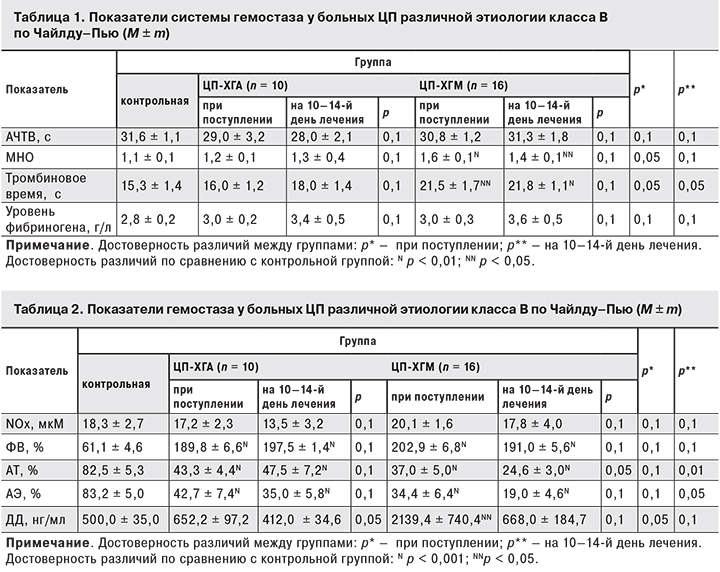
Показатели системы гемостаза у больных ЦП различной этиологии класса В по Чайлду–Пью представлены в табл. 1 и 2. Как видно из табл. 1, достоверные изменения произошли только в показателях МНО и тромбинового времени. Значения АЧТВ и уровня фибриногена не отличались от нормы и были одинаковы в обеих группах в течение всего периода пребывания в стационаре.
У больных ЦП-ХГМ значения МНО были достоверно выше нормы, в то время как при ЦП-ХГА они значимо не отличались от контрольных. Кроме того, при поступлении это значения были достоверно выше у больных ЦП-ХГМ, чем у пациентов с ЦП-ХГА (р < 0,05).
Показатель тромбинового времени у больных ЦП-ХГМ также был выше не только контрольных значений, но и показателей при ЦП-ХГА как при поступлении, так и через 2 недели лечения.
Как видно из табл. 2, и при ЦП-ХГА, и при ЦП-ХГМ концентрация NOx отмечалась в пределах контрольных величин и не зависела от этиологии.
Активность ФВ у всех больных ЦП были в 3 раза выше, чем в контрольной группе (р < 0,001) как при поступлении, так и на 10–14-й день лечения.
Уровни АТ и АЭ отмечались практически в 2 раза ниже контрольных значений как при поступлении, так и на 10–14-й день лечения (р < 0,001) у всех больных ЦП класса В по Чайлду-Пью. Через 2 недели пребывания в стационаре уровни АТ и АЭ были значимо ниже при ЦП-ХГМ, чем при ЦП-ХГА.
При ЦП-ХГМ исходный уровень ДД был достоверно выше нормы и показателей у больных ЦП-ХГА (р < 0,05).
В связи с большой вариабельностью активности некоторых показателей гемостаза был проведен их анализ в зависимости от степени изменения:
АЧТВ, тромбиновое время, МНО и уровень фибриногена: 1-я подгруппа – в пределах нормы (N), 2-я подгруппа – выше N, 3-я подгруппа – ниже N:
- концентрация NOx: 1-я подгруппа – в пределах нормы (N); 2-я подгруппа – умеренный уровень (выше N);
- активность ФВ: 1-я подгруппа – в пределах нормы (N); 2-я подгруппа умеренная активность (> N до 3N), 3-я подгруппа – высокая активность (> 3N);
- концентрация ДД: 1-я подгруппа – в пределах нормы (N); 2-я подгруппа – умеренный уровень (> N до 3N); 3-я подгруппа – > 3N.
Дальнейший детальный анализ подтвердил наши среднестатистические данные.
Больных, относящихся к 1-й подгруппе по показателю активности ФВ, не было ни в одной группе. При поступлении ко 2-й подгруппе по этому показателю относились 50% больных ЦП-ХГА и только 12% больных ЦП-ХГМ (р < 0,05) при одинаковых средних его значениях, но на 2-й неделе стационарного лечения активность ФВ была выше у больных ЦП-ХГМ: 176,3 ± 3,1% против 158,7 ± 6,9% (р < 0,05).
Удельный вес больных 3-й подгруппы при поступлении был выше среди пациентов с ЦП-ХГМ, чем с ЦП-ХГА: 87,5 и 50% соответственно (р < 0,05), но показатель активности ФВ на 10–14-й день лечения достоверно уменьшился только у больных ЦП-ХГА – с 210,7 ± 0,8 до 197,5 ± 1,4% (р < 0,001).
Таким образом, как удельный вес пациентов с высокой активностью ФВ, так и степень его активности были достоверно выше при ЦП-ХГМ.
По уровню ДД удельный вес пациентов 1-й подгруппы при поступлении был одинаков среди больных как ЦП-ХГА, так и ЦП-ХГМ, но на 10–14- й день лечения доля больных ЦП-ХГА достоверно увеличивалась с 40 до 90% (р < 0,05). Удельный вес больных 2-й подгруппы по этому показателю при поступлении среди пациентов с ЦП-ХГА был значительно выше: 60% против 12,5% больных ЦП-ХГМ (р < 0,05), но достоверно снизился к выписке с 60 до 10% (р < 0,05). Доля пациентов, относящихся к 3-й подгруппе, среди больных ЦП-ХГМ составила 43,75%, в то время как среди больных ЦП-ХГА таковых вообще не было (р < 0,05). К выписке эта доля также достоверно уменьшилась с 43,75 до 12,5% (р < 0,05).
Можно констатировать, что у больных ЦП класса В по Чайлду–Пью значения МНО и длительность тромбинового времени были выше нормы в течение всего периода лечения у пациентов с ЦП-ХГМ по сравнению с больными ЦП-ХГА. Это может свидетельствовать о более выраженных нарушениях в системе гемостаза при ЦП-ХГМ по сравнению с ЦП-ХГА, что, вероятно, связано с наличием двух повреждающих факторов.
Показатели АТ и АЭ при ЦП в исходе ХГА и ХГМ были достоверно ниже контрольных значений в течение всего периода лечения, но на 10–14-й день терапии у пациентов с ЦП-ХГМ они были достоверно меньше, чем у пациентов с ЦП-ХГА. Снижение уровня АТ при алкогольной и сочетанной этиологии заболевания связано с тем, что и этанол, и ВГС оказывают ингибирующее воздействие на тромбоцитопоэз в костном мозге [14, 15]. Доказано, что под воздействием этанола ингибируются образование и гранулярная секреция тромбоксана А2, который является важным медиатором активации тромбоцитов [15].
Активность ФВ достоверно выше нормы отмечалась в течение всего времени пребывания в стационаре и не зависела от этиологии ЦП. Удельный вес пациентов с высокой активностью ФВ и степень активности данного фактора были достоверно выше при ЦП-ХГМ. Повышенная активность ФВ у пациентов всех групп, вероятно, отражает нарушение функционального состояния эндотелия в виде его повреждения при сохраняющейся активности цитолитического процесса в печени. Более выраженное нарушение функционального состояния эндотелия при сочетанной этиологии патологического процесса объясняется воздействием ВГС на эндотелиоциты. Об этом свидетельствуют исследования N.F. Fletcher и соавт. [16], в ходе которых были обнаружены части вирусного генома в клетках эндотелия сосудов головного мозга у умерших больных ГС.
Исходный уровень ДД при ЦП-ХГМ был достоверно выше контрольных значений и показателей у пациентов ЦП-ХГА. Удельный вес пациентов с высокой концентрацией ДД был достоверно выше при ЦП-ХГМ, что отражает повышенную склонность к тромбообразованию на фоне выраженного повреждения эндотелия.
Таким образом, установлено, что у больных ЦП класса В по Чайлду-Пью уровень МНО, длительность тромбинового времени и активность ФВ и ДД достоверно выше при ЦП-ХГМ по сравнению с ЦП-ХГА, что свидетельствует о более выраженных нарушениях в системе гемостаза в связи с наличием двух повреждающих факторов.


