В настоящее время известно, что многие физиологические и патологические процессы в организме происходят при участии свободных радикалов – активных форм кислорода (АФК) и азота, содержащих один или несколько неспаренных электронов на внешней оболочке. В норме свободные радикалы играют важнейшую роль в передаче клеточных сигналов, транскрипции генов и иммунных реакциях [1]. Свободнорадикальное окисление представляет собой процесс непосредственного переноса кислорода на субстрат с образованием перекисей, кетонов, альдегидов, причем характерной чертой данной реакции является ее цепной, самоиндуцирующий характер [2].
Примером позитивной роли свободных радикалов является продукция биоцидных АФК полиморфноядерными лейкоцитами и макрофагами в процессе фагоцитоза. Классическим примером свободнорадикальных процессов в организме является и перикисное окисление липидов (ПОЛ), протекающее преимущественно в биологических мембранах, инициирующим фактором которого выступают различные АФК. Реакции ПОЛ являются необходимым этапом многих метаболических процессов, в том числе пролиферации клеток, метаболизма белков, липидов, нуклеиновых кислот, регуляции клеточной проницаемости и рецепторной функции мембран [3].
 Свободные радикалы и АФК оказывают воздействие на различные компоненты клеток, прежде всего на содержащие ненасыщенные жирные кислоты липиды плазматических мембран. От скорости обмена фосфолипидов зависит интенсивность перестройки клеточной мембраны и способность адекватно реагировать на изменения внешней и внутренней среды [4, 5].
Свободные радикалы и АФК оказывают воздействие на различные компоненты клеток, прежде всего на содержащие ненасыщенные жирные кислоты липиды плазматических мембран. От скорости обмена фосфолипидов зависит интенсивность перестройки клеточной мембраны и способность адекватно реагировать на изменения внешней и внутренней среды [4, 5].
Еще больший интерес представляют роль и место свободнорадикального окисления при воспалении. В генезе нарушения проницаемости капилляров и отека при воспалительной реакции одним из важнейших механизмов является усиление генерации свободных радикалов, что усугубляет микроциркуляторные расстройства в очаге воспаления. В острой фазе бактериальной инфекции тканевые фагоциты и лейкоциты крови продуцируют максимальное количество радикалов. Массированный выброс свободных радикалов из клеток приводит к необратимому повреждению не только микробов, но и клеток и тканей организма хозяина [6].
Для ограничения деструктивного процесса и защиты клеток от повреждающего действия свободных радикалов в организме высших животных и человека в процессе эволюции выработался комплекс защитных механизмов, который принято обозначать как антиоксидантную систему (АОС). Эндогенными антиоксидантами являются энзимы (супероксиддисмутаза, каталаза, глутатионпероксидаза и ряд других), соединения неэнзимной природы (липоевая и мочевая кислоты, билирубин, мелатонин, убихинол) и некоторые белки, связывающие металлы (ферритин, лактоферрин, трансферрин, церулоплазмин) [7]. При достаточном уровне АОС в организме образуется то количество продуктов ПОЛ, которое необходимо для регуляции физиологических процессов. При снижении содержания антиоксидантов в тканях продукты ПОЛ начинают оказывать патологический эффект. Угнетение АОС при инфекционном заболевании может служить прогностическим критерием тяжелого течения процесса [8].
Особенно велика роль ПОЛ и АОС при кишечных инфекциях бактериальной этиологии. Эндотоксины бактерий активируют простагландиновый каскад, интенсифицируют свободнорадикальное окисление, продукты которого обладают прямым цитотоксическим эффектом, повреждают мембраны, тем самым вновь активизируют высвобождение субстрата для биосинтеза простагландинов [9, 10]. У больных, у которых дизентерия протекала с осложнениями, имелись достоверно более выраженные изменения АОС, они не устранялись к периоду ранней реконвалесценции [11].
 Среди тканевых антиоксидантов особое место занимают тиолы, сульфгидрильные (SH-) группы которых способны с высокой скоростью окисляться в дисульфидные (SS-), что обусловливает их антирадикальное и антиперекисное действие. Основная роль SS-групп заключается в способности стабилизировать молекулярную структуру белка, с биологическими свойствами SS-групп сопряжены механизмы тканевого дыхания, мембранной проницаемости и другие. Таким образом, наряду с веществами липидной природы, тиоловые соединения принимают широкое участие в защите клеточных структур от действия окисляющих факторов [12].
Среди тканевых антиоксидантов особое место занимают тиолы, сульфгидрильные (SH-) группы которых способны с высокой скоростью окисляться в дисульфидные (SS-), что обусловливает их антирадикальное и антиперекисное действие. Основная роль SS-групп заключается в способности стабилизировать молекулярную структуру белка, с биологическими свойствами SS-групп сопряжены механизмы тканевого дыхания, мембранной проницаемости и другие. Таким образом, наряду с веществами липидной природы, тиоловые соединения принимают широкое участие в защите клеточных структур от действия окисляющих факторов [12].
Материалы и методы
Нами было обследовано 400 больных острой бактериальной дизентерией различной степени тяжести в возрасте от 18 до 65 лет, госпитализированных в отделение кишечных инфекций Республиканского Центра инфекционных болезней (Махачкала) в 2005–2014 гг. Группу контроля составили 30 условно здоровых доноров.
Верификацию этиологии ОКИ проводили путем бактериологического посева калового материала по общепринятой методике в первые часы после поступления больного в стационар, до начала антибактериальной терапии [13]. Оценка тяжести течения заболевания и его клинических вариантов осуществлялась в соответствии с методическими рекомендациями «Бактериальная дизентерия у взрослых. Диагностика и лечение на современном этапе» [14].
Для оценки функционального состояния тиолдисульфидного компонента АОС у больных острой дизентерией определяли содержание SH- и SS-групп в гемолизате. По соотношению SH- и SS-групп вычислялся тиолдисульфидный коэффициент (ТДК), отражающий буферную емкость АОС. Для количественного определения SS-групп использовали методику В.В. Соколовского и соавт. (1988), основанную на способности ионов серебра образовывать прочную меркаптидную связь с SH-группами [15].
Результаты и обсуждение
Среди обследованных пациентов у 112 (28,0%) было диагностировано легкое течение острой бактериальной дизентерии, у 192 (48,0%) – среднетяжелое и у 96 (24,0%) – тяжелое. В большинстве случаев – у 364 (91,0%) пациентов – заболевание протекало по колитическому варианту, у остальных 36 (9,0%) имелись симптомы гастроэнтероколита.
По данным бактериологического исследования, в этиологической структуре преобладала шигелла Флекснера 2а, незначительно высевались шигеллы Зонне (рис. 1), что соответствует данным по Российской Федерации в целом [13].
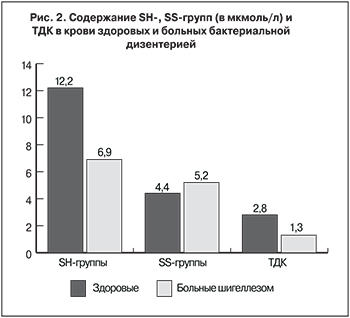
В результате исследования выявлено, что в острый период заболевания шигеллезом наблюдается достоверное снижение содержания SH-групп и ТДК в сравнении с показателями в контрольной группе (p < 0,05), концентрация SS-групп, напротив, повышена (рис. 2).
Также было проведено более детальное изучение этих показателей с учетом тяжести инфекционного процесса. Выявлено, что у больных с тяжелым течением острой бактериальной дизентерии содержание в крови SH-групп ниже, чем у здоровых, в 2,3 раза, а у больных со среднетяжелым и легким течением – в 1,7 и 1,5 раза соответственно, причем различие между здоровыми и больными дизентерией любой степени тяжести достоверно (р < 0,05). Нами установлена прямая корреляционная связь высокой степени между содержанием SH-групп и тяжестью течения дизентерии (r = 0,78).
Содержание SS-групп также коррелировало с тяжестью инфекционного процесса, но в меньшей степени (r = 0,36), и различия по этому показателю оказались достоверными только между здоровыми и больными тяжелой дизентерией. Значения ТДК как производного от соотношения SH- и SS-групп также различались у здоровых и больных острой дизентерией. Различия были достоверны вне зависимости от тяжести течения заболевания (см. таблицу).

Следует обратить внимание на инверсию соотношения SH- и SS-групп при тяжелом течении острой бактериальной дизентерии, что указывает на качественные изменения в соотношении свободнорадикального окисления и АОС в этом случае. Кроме этого, можно отметить, что показатели содержания SH-групп и ТДК достоверно отличаются у пациентов с тяжелым и легким течением заболевания (p < 0,05).
Таким образом, нами установлено патогенетическое значение изменений показателей тиолдисульфидного звена АОС при острой бактериальной дизентерии. Изменение соотношения оксидативных процессов и АОС имеет место при заболевании любой степени тяжести, но при тяжелом течении эти изменения приобретают качественный характер. Очевидно, наличие выявленных патогенетических механизмов следует учитывать при ведении больных острой бактериальной дизентерией.
Представляется рациональным включать в стандарты обследования при бактериальной дизентерии определение показателей тиолдисульфидного звена как дополнительный критерий тяжести и прогноза течения заболевания. Превышение концентрации SS-групп над SH-группами и инверсия ТДК являются маркерами срыва АОС и прогностически неблагоприятными факторами. Если вопрос о применении лекарственных средств антиоксидантного действия при острой бактериальной дизентерии в общем может обсуждаться, то тяжелое течение инфекционного процесса, по нашему убеждению, является неоспоримым основанием для включения в терапевтический комплекс антиоксидантных препаратов.
Учитывая механизм выявленных нарушений в АОС, можно обсуждать вопрос об использовании адеметионина, убидекаренона и некоторых других лекарственных средств, участвующих в переносе электронов в транспортной цепочке окислительно-восстановительных процессов, в процессе обмена энергии и реакциях окислительного фосфорилирования в дыхательной цепи митохондрий клеток.


