…к нашим знаниям о бешенстве примешивалось
множество предрассудков.
Луи Пастер
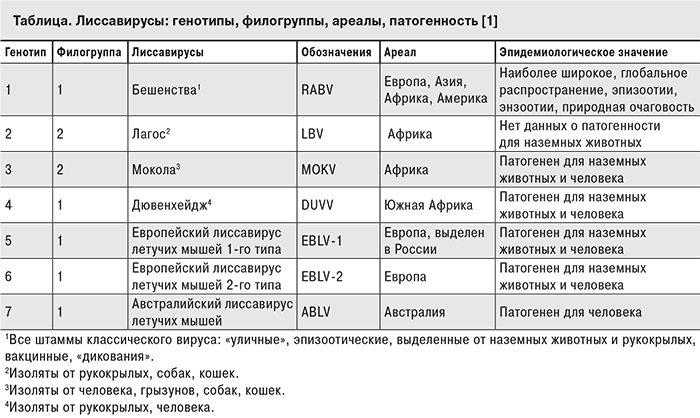
Бешенство – фатальный прогрессирующий энцефалит вирусной этиологии всех млекопитающих, инфекция с самым высоким уровнем летальности среди прочих инфекционных болезней. Возбудителями являются близкие по структуре генома и филогенезу представители рода Lyssavirus семейства Rhabdoviridae с гомологией аминокислотных последовательностей по общему родовому антигену (нуклеопротеину) на уровне 78–93% (см. таблицу) [1].
Список из 7 охарактеризованных генотипов, приведенных в таблице, в последнее время пополнен новыми генетически самостоятельными лиссавирусами рукокрылых: 5 выделенными в Евразии [Араван (ARAV), Ходженд (KHUV), западно-кавказский (WCBV), Иркут (IRKV), Ллейда (LLBV)] и одним африканским [Икома (IKOV)], эпидемиологическое и иное значение которых исследовано сравнительно недостаточно.
Принципиально важно, что рукокрылые являются первичным или единственным паразитосистемным хозяином и природно-очаговым резервуаром всех описываемых выше лиссавирусов, кроме вируса Мокола, природный резервуар которого пока не установлен [1, 2].
Естественно-исторические предпосылки проблемы
На рубеже прошлого и текущего столетий рабическая инфекция характеризуется поучительной естественно-исторической картиной. Наиболее значимые в контексте темы элементы сводятся к следующему [3]:
- с 1940-х гг. в Европе началось и к 1970-м гг. завершилось формирование преобладающего, нового для региона природно-очагового «лисьего» экотипа болезни, альтернативного классическому (пастеровскому) городскому «собачьему» экотипу, с радикальным изменением биологических свойств вируса вследствие его адаптации к новой паразитарной системе. Прежде всего это выразилось в значительном снижении вирулентности и супрессии канонических клинических признаков и летальности (хронизация течения заболевания у лисиц);
- с начала развития ситуации до 2000-х гг. сформировался суперареал бешенства с чрезвычайно высокой территориальной плотностью инфекции (от 250 до более 850 случаев в год на 100 000 км2), эпицентром которого стала вытянутая с севера на юг в меридиональном направлении (около 16–24 восточной долготы и 55–43 северной широты) зона Центральной Европы, включающая страны от Прибалтики до северных границ Болгарии (Центрально-Европейский суперареал – ЦЕС);
- заболеваемость приобрела поступательную фронтальную диффузию в западном направлении, достигнув к 1970-м гг. территории стран атлантического побережья (Бельгии, Голландии, Франции). Ежегодная инцидентность в Европе превышала 25 000 случаев с вовлечением диких (премущественно) и домашних (в том числе сельскохозяйственных) животных с большими экономическими потерями и сложностями социального порядка;
- в связи с этим после научного и практического осознания экологической и эпизоотологической сущности «нового» бешенства в результате интенсивной работы ученых и специалистов, понимания сути происходящего со стороны властей и общественности неблагополучных государств Западной Европы были разработаны и успешно реализованы рациональные стратегия и тактика контроля и искоренения природно-очагового бешенства на основе оральной вакцинации лисиц (ОВЛ). В начале 2000-х гг. инцидентность бешенства была снова сконцентрирована в пределах ЦЕС, куда в настоящее время направлена международная корпоративная противоэпизоотическая активность под эгидой ЕС;
- в период успешной кампании по искоренению бешенства природно-очагового экотипа в Западной Европе появились признаки аналогичной диффузии его инцидентности в восточном направлении («маятник» качнулся в противоположную сторону). С 1999 г. (первая регистрация явления) до настоящего времени происходит градуальное смещение ЦЕС «лисьего» бешенства и пиковых значений инцидентности с вектором запад→восток от Польши до центральных областей РФ (рис. 1, см. на вклейке) с ростом территориальной плотности инфекции (в регионе Смоленской и Московской областей в последние годы – более 500 случаев на 100 000 км2). Бешенство продолжает распространяться на восток, захватывая Ярославскую, Ивановскую, Владимирскую области и сохраняя природно-очаговый стереотип;
- по мере освобождения всех западноевропейских стран от наземного природно-очагового бешенства здесь стали регистрировать десятки и сотни случаев бешенства (точнее позитивности по бешенству) воздушно-наземного экотипа среди летучих мышей, широко распространенных в регионе, с возрастающей частотой, позволяющей рассматривать ситуацию уже в эпидемических категориях.
О связи случаев бешенства наземных млекопитающих с рукокрылыми известно, начиная с испанской колонизации Южной Америки (ХVI в.), и уже определенно осознана эпидемическая роль летучих мышей-вампиров, питающихся кровью животных, по реальным эпизоотиям среди крупного рогатого скота (КРС) в ХVI, ХVIII и XIX вв. Окончательное доказательство заражения от летучих мышей-вампиров паралитическим бешенством КРС – обнаружение телец Негри у летучих мышей в Бразилии в 1911 г., тогда как в то время считалось, что они характерны только для бешенства диких животных.
Дальнейшими исследованиями, в том числе вирусологическими, в 1920–1930-х гг. установлено, что в некоторых регионах Южной Америки возникают эпизоотии бешенства среди летучих мышей с вовлечением не только плотоядных гематофагов (преимущественно), но и фруктоядных и насекомоядных. В 1951 и 1953 гг. в США зарегистрированы первые 2 случая заражения гидрофобией людей вследствие укусов летучими мышами.
Вскоре после этого бешенство рукокрылых было обнаружено во многих странах Центральной и Южной Америки, в Канаде, у всех видов летучих мышей в Северной Америке, далее – в Африке (Нигерия) у фруктоядных крылановых, в Европе (Югославия, Германия, Турция) – у насекомоядных кожанов. В настоящее время бешенство летучих мышей-вампиров у КРС – уникальное экономически значимое заболевание [4, 5].
Реальное значение грызунов в эпидемиологии бешенства
На территории европейских стран бешенство рукокрылых периодически обнаруживалось, начиная с 1954 г. Однако такие факты оценивались как чистая казуистика, не имеющая никакого эпидемиологического значения. В 1950–1960-е гг. приоритетное место в спекуляциях относительно криптических циклов рабической инфекции в неподдающихся выяснению инцидентах отводили представителям отряда Rodentia.
«Грызуновая» концепция в эпидемиологии европейского бешенства возникла во второй половине 1940-х гг. для объяснения случаев заболевания домашних, околодомашних животных и человека без «привычных» контактов с агрессивными бешеными собаками и другими представителями отряда Carnivora, вне очевидной цепной передачи через укусы. Для этого потребовались предположения об источниках криптогенного характера, где наиболее предпочтительным оказался отряд грызунов – самая многочисленная группировка восприимчивых млекопитающих.
«Грызуновая» концепция всерьез воспринималась рабиологами вплоть до окончательного признания уникальности и преобладания на территории Западной Европы, а затем и в России природно-очагового типа наземной инфекции с лисами в качестве безальтернативного резервуара. Наиболее убедительным свидетельством ее недостоверности явились разработка и успешное применение стратегии радикального сокращения восприимчивости именно этого паразитосистемного хозяина и искоренения тем самым инфекции в труднодоступных природных условиях его обитания путем ОВЛ на территории всей Западной Европы на рубеже ХХ–ХХI вв. (см. рис. 1 на вклейке).
О несостоятельности концепции о резервуарной роли грызунов при бешенстве свидетельствуют результаты серьезных исследований в этой области. В 1969–1979 гг. (период, предшествующий началу применения европейской стратегии ОВЛ) в рамках Координационной исследовательской программы ВОЗ/ФАО по бешенству диких животных в Европе от свыше 3000 мелких диких грызунов [различных мышиных (Muridae) и преимущественно серых полевок (рода Microtus)] были получены более 70 изолятов вируса, отличающихся от стандартного уличного вируса по ряду биологических свойств. Выделение изолятов было рационально скоординировано с характером местных эпизоотических ситуаций (благополучие, эпизоотии, энзоотии).
Изоляты этой группы получили изначально название «вирусов, подобных бешенству» (rabies-like), а в дальнейшем, по рекомендации Референсной лаборатории ВОЗ по бешенству, – «мышиные варианты вируса бешенства». Они различались по интрацеребральной вирулентности для белых мышей; при экстраневральном заражении были патогенны для лабораторных животных, собак и лисиц; обладали выраженным висцеротропизмом и способностью вызывать нелетальную инфекцию. Инфекция мелких грызунов-источников изолятов отличалась низкой частотой выделения вируса и относительно низким его количественным содержанием в тканях.
Учитывая тот факт, что мелкие грызуны служат основной пищей для лисиц и составляют с ними систему «жертва + хищник», то есть имеют теснейшую, экосистемно обоснованную связь, эти результаты дали некоторые основания для продолжения спекуляций на заданную тему. Предполагалось, что такое разнообразие вирусных изолятов от грызунов могло оказаться следствием естественно модифицирующих пассажей типа «мышь→мышь» с учетом высокой плотности природных популяций последних [6].
Однако позднее, в 1986–1990 гг., более 10 000 мелких наземных млекопитающих 16 видов и около 2000 грызунов 12 видов, имевших повреждающие контакты с людьми, были тестированы на наличие инфекции и возможную их роль в эпидемиологии бешенства. Не выявлено ни одного положительного случая. Результаты столь фундаментального исследования уже на основании экспериментальных данных окончательно дезавуируют «грызуновую» концепцию бешенства [7].
Клиническая картина и эпизоотическая цепь бешенства у европейских летучих мышей
С резким увеличением частоты регистрации случаев бешенства летучих мышей в разных странах с 1985 г. стало очевидно, что оно представляет собой действительно самостоятельную, независимую от классических наземных («лесной», «городской»), воздушно-наземную паразитарную систему простого закрытого двучленного типа, возможно, новую для Европы, с определенными впоследствии имманентными генотипами вируса – европейскими вирусами летучих мышей EBLV-1 и EBLV-2 (см. таблицу) [1, 4].
В настоящее время эта разновидность рабической инфекции, по крайней мере, в свободной от наземного бешенства и RABV Западной Европе, в связи с восприимчивостью человека становится возможной альтернативой бешенству «лисьего» экотипа.
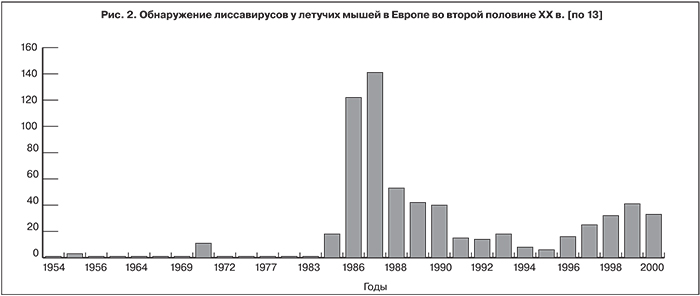
История клинического изучения бешенства летучих мышей базируется на активных научных программах, реализуемых в ряде европейских стран (Германия, Голландия, Дания, Испания, Франция), что позволяет достаточно подробно оценить характер заболевания у этих животных. Используемые данные включают статистику и описания около 700 случаев бешенства летучих мышей, зарегистрированных в 17 европейских странах до 2000 г. (рис. 2) [2, 4, 6].
Некоторые наиболее общие и принципиальные клинико-эпидемиологические элементы бешенства летучих мышей сводятся к следующему [4]:
- первыми клиническими признаками заболевания у летучих мышей, как и классического бешенства у всех млекопитающих, являются изменения типичного поведения: отсутствие обычной настороженности, появление в несвойственных местах, в необычное время суток (как у диких плотоядных), агрессивность, судороги, коматозное состояние, параличи;
- насекомоядные летучие мыши в естественной среде обитания активны в темное время суток, во время кормления и охоты на сумеречных и ночных насекомых. Их появление в дневное время практически невозможно и нецелесообразно (дневной покой в прохладных убежищах, сравнительно высокая температура наружного воздуха, отсутствие объектов охоты, невостребованность эхолокации и другие факторы). Если летучая мышь обнаруживается днем, то уже одно это является ненормальным и должно служить поводом для подозрения на наличие у нее бешенства, по аналогии с дневным появлением лисицы на используемых человеком территории или объекте при бешенстве природно-очагового экотипа;
- частота эпидемически значимых контактов больных бешенством летучих мышей с людьми в подавляющем большинстве казуистична и ограничивается единичными случаями;
- характер контактов представляет как физическое общение (ловля, подбирание, освобождение и другие манипуляции), так и спонтанную, неспровоцированную агрессию, неожиданное нападение на людей и нанесение им травм. Все зафиксированные случаи заражения людей произошли вследствие укусов или царапин, что относит бешенство летучих мышей по типу передачи к инфекциям с иньекционной трансдермальной передачей (bat scratch infection);
- все случаи заболевания возникают и заканчиваются по типу spill over – тупиковой фатальной инфекции без последующей цепной передачи.
Бешенство для самих летучих мышей также летально. Наблюдение клинической картины заболевания у животных констатирует длительный инкубационный период (по единичным зарегистрированным свидетельствам): при спонтанной инфекции – по крайней мере, 6 недель, при экспериментальном заражении – 5–10 дней. Продолжительность клинического периода в эксперименте составила 36 ч. Летучие мыши высокочувствительны к интрацеребральному заражению; периферическое экстраневральное (внутимышечное и подкожное) введение вируса не всегда эффективно. В период заболевания отмечаются необычно энергичное движение, нападение на неодушевленные предметы, крики, отсутствие аппетита, взъерошенный мех, выгибание спины, агрессивное поведение, укусы, последующее быстрое нарастание слабости, паралитическое состояние (отмечается редко). Основным патологическим изменением в мозге летучих мышей, инфицированных EBLV, является негнойный менингоэнцефаломиелит (лимфоцитарная инфильтрация), аналогичный тому, который наблюдается у наземных животных. Тельца Негри выявляются непостоянно. Вирус выделяется из головного, продолговатого мозга и некоторых тканей, нерегулярно – из тканей слюнной железы [2, 4].
Данные характеристики свидетельствуют об отношении бешенства летучих мышей к классическому бешенству наземных животных, вызываемому RABV 1-го генотипа. Однако, помимо этого, существует ряд признаков, которые, несмотря на немногочисленность исследований и неоднозначность трактовок, представляют гипотетическую возможность рассмотреть бешенство летучих мышей с позиций новой паразитарной системы «летучие мыши + европейские лиссавирусы летучих мышей». К ним относится [4, 8]:
- отсутствие или некоторые морфологические особенности нерегулярно выявляемых телец Негри при очевидном бешенстве летучих мышей, устанавливаемом по положительному результату иммунофлюоресцентного тестирования;
- нерегулярность выявления вируса в слюнных железах;
- снижение вирулентности.
В настоящее время абсолютно преобладающее на территории РФ и западных республик бывшего СССР бешенство природно-очагового «лисьего» экотипа отличается от классического по сути теми же признаками, которые отмечены выше для бешенства летучих мышей [3, 9]:
- отсутствием телец Негри при положительных результатах иммунофлюоресцентного тестирования;
- низкой эффективностью передачи инфекции при контактах с восприимчивыми млекопитающими других видов;
- сравнительно низкой вирулентностью вируса, что сопровождается хронизацией и асимптоматическим (атипичным) течением инфекции у лисиц, супрессией клинических признаков у собак в случае заражения при спонтанных контактах с лисицами.
Эти очень важные аналогии вирусологического, эпизоотологического и патогенетического порядка очевидно указывают на то, что бешенство рукокрылых приобрело признаки природной очаговости в соответствии с принципом Е.Н. Павловского относительно адаптационной изменчивости паразита при переходе на нового хозяина с формированием паразитарной системы и новых паразито-хозяинных отношений, в данном случае «вирус бешенства + летучие мыши». При этом уместно сослаться на закон гомологических рядов изменчивости при обитании в экологически сходных условиях Н.И. Вавилова.
Хотя детали естественной циркуляции европейских, австралийского, африканских лиссавирусов рукокрылых (см. таблицу) не выяснены до такого уровня, как для RABV, важно, что, по аналогии с RABV, их трансмиссия от резервуарного хозяина другим млекопитающим осуществляется по тривиальной для классического бешенства схеме «энцефалит→агрессивность→укус→трансдермальное заражение→заболевание типа spill over». Возникающие при заражении обстоятельства также аналогичны: внезапность нападения, активное травмирующее воздействие (укусы, царапины), беззащитность, нередко неосторожность жертвы [4, 8, 10].
Спорадическое бешенство нерезервуарных млекопитающих с идентификацией лиссавирусов рукокрылых типа spill over, то есть случайная, тупиковая заболеваемость животных, которые не обеспечивают естественной циркуляции инфекции, – исключительно редкие явления, имеющие характер индекс-случаев; в числе известных – случаи заражения людей EBLV-1 и -2, ABLV, DUVV; овец, домашних и диких плотоядных – EBLV-1 и LBV.
Негригенность и вирулентность вируса бешенства
Тельца Негри – некогда универсальный маркер бешенства классической формы, служивший с начала ХХ в. надежным диагностическим критерием, своего рода «золотым стандартом». Эти базофильные внутриклеточные включения представляют собой цитоплазматические компартменты сборки нуклеопротеиновых сердцевин вирусных частиц, предшествующей окончательному созреванию вирусов при почковании через клеточную мембрану. Именно они как цитоплазматические антигены, образующиеся при репродукции всех вирусов, реагируют с флюоресцирующими антителами общей, надвидовой (родовой) специфичности в противоположность антигенам, экспонированным на поверхности вирусных частиц, реагирующим в нейтрализующих, задерживающих гемагглютинацию и т. п. тестах и ответственным за внутривидовую (серотиповую) специфичность.
Исторически, с первых лабораторных исследований по вирусологии, обнаружение цитоплазматических телец-включений (при бешенстве, чуме плотоядных и др.) имело диагностическое значение в идентификации конкретного заболевания, было патогномоничным признаком, то есть типичным для «дикого» вирулентного, наиболее полноценного и естественного варианта возбудителя. Поэтому их наличие свидетельствует в целом о нормальном морфогенезе вирусов. С другой стороны, отсутствие или какие-то изменения a priori служат свидетельством аномального развития и изменчивости.
Отсутствие телец Негри при бешенстве – факт, незаслуженно оставляемый без должного внимания рабиологами и не удостоенный должной интерпретации как в научной литературе, так и в практическом плане. Сам по себе феномен отрицательной негригенности был достаточно хорошо известен специалистам, работавшим в 1950–1960-е гг. в регионе, энзоотичном по бешенству степных лисиц-корсаков (юго-восток Казахстана), где незнание его сути значительно осложняло диагностику. Ситуация была спасена глобальным внедрением в диагностику бешенства метода флюоресцирующих антител, обеспечивающего сопряженное морфологическое и серологическое тестирование, – альтернативы гистологическому методу выявления телец Негри.
Различие в вирулентности вирусов классического бешенства RABV и EBLV было показано и в оригинальных экспериментах по восприимчивости летучих и лабораторных мышей. Вирус бешенства вызывал гибель 60% ночниц с продолжительным инкубационным периодом в 35 дней и паралитической формой течения инфекции; EBLV – гибель 9–24%, инкубационный период составлял 18–20 дней, и только в половине случаев проявлялись признаки агрессивного поведения и судороги [11].
Низкая вирулентность лиссавирусов летучих мышей для паразитосистемного хозяина свидетельствует о длительном периоде взаимоотношений в системе «паразит–хозяин», уже прошедших стадию усиления патогенности паразита на ранних этапах незрелости (принцип Одума) и впоследствии – стадию взаимной паразитосистемной интеграции (правило И.И. Шмальгаузена) по аналогии с природно-очаговым бешенством «лисьего» экотипа в Западной Европе. Если это заключение правильно, то на ситуацию с бешенством летучих мышей в Европе возможна экстраполяция научно-практических принципов методологии исследования и контроля природно-очаговой инфекции в центре России, концепций формирования центральноевропейского суперареала бешенства и его градуального смещения с вектором запад→восток вплоть до центральных областей РФ, сформулированных в 2001–2005 гг. при многолетнем анализе эволюционно-экологических закономерностей бешенства лесного, противоположного городскому, экотипа [9].
Рукокрылые резервуары и распространение воздушно-наземного бешенства
Летучие мыши и кожаны (Microchiroptera), наряду с другими млекопитающими, являются основным или одним из основных паразитосистемных хозяев 8 из 11 лиссавирусов, связанных с рукокрылыми; крылановые летучие лисицы (Megachiroptera) – 3.
Вирус классического бешенства RABV распространен среди рукокрылых и плотоядных-хищников в различных по экологическому стереотипу паразитарных системах в соответствии с их экологическим полиморфизмом (городское собачье, природно-очаговое лисье бешенство, и др.). В Западном полушарии среди рукокрылых циркулирует только RABV, в то время как в наземных паразитарных системах среди плотоядных RABV распространен во всем мире. В Восточном полушарии рукокрылые являются хозяевами других лиссавирусов – европейских (EBLV-1 и EBLV-2), австралийского (ABLV), африканских (Лагос, Дювенхейдж и др.). Для этих лиссавирусов рукокрылые являются основными хозяевами с крайне редкими случаями тупикового заражения наземных млекопитающих [4, 8, 12].
Америка. До последнего времени бешенством, связанным с южноамериканскими зоофильными летучими мышами-вампирами Desmodus rotundus, обусловливается значительный экономический ущерб скотоводству в энзоотических зонах. Поголовье КРС в зоне риска (Бразилия, Перу, другие страны Центральной Америки), превышающее 70 млн голов, подвергается нападению вампиров с инцидентностью укусов, варьирующей от 6 до 50% и более. Эпизоотические вспышки бешенства животных, связанные с вампирами, сопровождаются множеством контактов (укусов) людей и заболеваемостью гидрофобией в каждом седьмом случае. Этими обстоятельствами обусловлено вынужденное широкое применение антирабической вакцинации КРС как метода специфической профилактики бешенства «вампирного» экотипа.
У вампиров бешенство протекает в острой форме (аналогично течению болезни у наземных млекопитающих) с фатальным исходом. Животные с клиническими признаками начала заболевания выделяют вирус со слюной, что указывает на соответствие патогенетическому стереотипу рабической инфекции; энцефалит, провоцирующий изменение поведения (агрессивность), синхронизирован с центробежным невральным распространением вируса в организме, в том числе в слюнные железы как анатомически ближайшие органы выделения [5].
Несмотря на существующие противоречия относительно бессимптомного носительства RABV у вампиров с экскрецией вируса со слюной и их способности заражать при гематофагии или иными путями млекопитающих других видов, в том числе неплотоядных рукокрылых, этот механизм, постулируемый для природно-очагового наземного бешенства лисиц, согласно канонам саморегуляции паразитарных систем, в данном случае вполне естественно логичен как основа резервации инфекции и для типа «летучие мыши-вампиры + вирус бешенства».
В Северной Америке инцидентность бешенства, прежде всего человека, ассоциируется с насекомоядными летучими мышами разных родов и видов: Lasionycteris noctivagans и Perimyotis subflavus (преимущественно), Tadarida brasiliensis, Myotis spp., Eptesicus fuscus и Desmodus rotundus. Американские изоляты RABV от рукокрылых разных видов имеют геномные вариантные отличия соответственно их определенной хозяинной адаптации [8, 13].
Европа. С 1977 по 2014 г. в Европе было зарегистрировано в общей сложности 1085 случаев бешенства летучих мышей. Абсолютное большинство (более 90%) – в Нидерландах, Германии, Дании и Польше, затем, по нисходящей, – во Франции, в Испании, Украине, Великобритании. Инцидентность отмечена в Швейцарии, Чехии, Словакии, Венгрии, Румынии, Белоруссии, России. Ввиду объективности выборки статистика свидетельствует, что бешенство летучих мышей эндемично по всему континенту безотносительно к территориальной частоте выявления (рис. 3, см. на вклейке).
Установлены несколько фактов передачи европейских лиссавирусов наземным млекопитающим и их заболеваемости типа spill over. EBLV-1 и EBLV- 2 явились причиной случаев гидрофобии человека, EBLV-1 – бешенства овец (Дания, 1998 и 2002), каменной куницы (Германия, 2001), домашних кошек (Франция, 2003 и 2007) [2, 14].
Паразитосистемные хозяева лиссавирусов EBLV-1 и EBLV-2 – весьма многочисленные, убиквитарные на континенте и экологически активные насекомоядные летучие мыши родов Eptesicus spp. (кожаны) и Myotis spp. (ночницы) соответственно. EBLV-1 распространен повсеместно, EBLV-2 регистрируется в Нидерландах, Великобритании, Швейцарии, Германии и Финляндии. Относительно новые лиссавирусы летучих мышей на территории Европы – WCBV (западно-кавказский вирус летучих мышей), BBLV (Bokeloh bat lyssavirus) – в Германии и Франции, LLEBV (Lleida bat lyssavirus) – в Испании [2].
Так же как и в Америке, в ряде европейских стран проводится интенсивный мониторинг эпизоотической ситуации по бешенству летучих мышей с идентификацией и всесторонним изучением изолятов лиссавирусов с точки зрения их диверсификации. На этом основании важно, что новые европейские изоляты лиссавирусов (WCBV и LLEBV) не имеют перекрестного антигенного родства с остальными лиссавирусами и могут представлять независимую филогруппу, то есть стандартные средства профилактики и лечения (антирабические вакцины и сыворотки) против них неэффективны [2].
Австралия. Природные циклы ABLV на исторически свободном от бешенства пятом континенте неожиданно обнаружены в 1996 г. после установления роли летучих лисиц рода Pteroptus spp. в эмерджентном возникновении болезни Хендра и мотивации вследствие этого надзора за рукокрылыми. Впервые ABLV был изолирован у больной летучей лисицы P. alecto с признаками энцефалита и необычной агрессивности, позднее – у всех 4 континентальных видов летучих лисиц. По наличию серопозитивности было установлено его распространение в Таиланде [15].
Африка. Лиссавирус Лагос, впервые выделенный в Нигерии в 1956 г., обнаруживается во многих странах к югу от Сахары. Его паразитосистемными хозяевами служат фруктоядные крылановые нескольких видов. Инфекция LBV регистрируется у мелких млекопитающих – собак, кошек, мангуста. Лиссавирус Шимони выделен в Кении в 2009 г. у насекомоядной летучей мыши-листоноса Hipposideros commersoni. Для обоих вирусов эпидемиологическое значение не определено, но они обладают патогенностью для лабораторных животных при интрацеребральном и периферическом заражении с развитием признаков бешенства и летальностью, относятся ко 2-й филогруппе лиссавирусов (см. таблицу). По G-белку эти вирусы антигенно отличаются от остальных членов рода, против них не эффективны стандартные антирабические биопрепараты.
Африканский лиссавирус летучих мышей Дювенхейдж, выделенный от насекомоядных летучих мышей-длиннокрылов рода Miniopterus spp., распространен в их популяциях в ЮАР и ряде других стран юга континента. DUVV входит в 1-ю филогруппу, и на него распространяется профилактическое и терапевтическое действие антирабических средств [12, 16].
Серопозитивность к западнокавказскому лиссавирусу летучих мышей (WCBV) установлена у представителей рода Miniopterus spp. в Кении, что свидетельствует о возможном афро-азиатском диапазоне его распространения соответственно ареалу потенциального природного хозяина [8].
Таким образом, лиссавирусы, в том числе вирус классического бешенства, и рукокрылые представляют собой экологически и эпидемиологически самостоятельные паразитарные системы рабической инфекции воздушно-наземного экотипа. Они полностью независимы от паразитарных систем природно-очаговых и городских экотипов с участием диких (лисы, еноты, скунсы и др.) и синантропных (собаки) плотоядных соответственно, имеют своих хозяев и автохтонные виды вирусов. Более того, паразитарные системы «лиссавирусы + рукокрылые» существуют и там, где вообще нет наземного бешенства (на территории Австралии и ряда близлежащих островов).
Бешенство рукокрылых у человека
На протяжении новейшей истории европейские лиссавирусы стали причиной нескольких случаев бешенства у человека, в том числе с идентификацией вируса. Принципиально важно, что обусловленные контактами с рукокрылыми клинически выраженные случаи зарегистрированы на территории Восточной Европы (Украина, РФ), а также на Дальнем Востоке (вирус Иркут) и в Китае [4, 10].
До настоящего времени зарегистрированы 2 летальных случая заражения человека ABLV вскоре после его обнаружения – в 1996 и 1998 гг. Примечательно, что во втором случае инкубационный период после контакта с источником заражения составил 27 мес. [17]. Установлены 3 случая летального бешенства, причиной которых был DUVV, вследствие контактов с летучими мышами Miniopterus spp. [2]. Учитывая фатальность и особую ветеринарно-эпидемиологическую значимость каждого инцидента, они служат свидетельством потенциального риска непредсказуемой опасности для человека со стороны континентально эндемичных популяций рукокрылых (по крайней мере, в Евразии).
Против инфекции, вызванной лиссавирусами рукокрылых генотипов 1, 4–7 (RABV, EBLV-1, EBLV- 2, ABLV, DUVV), принадлежащих к 1-й филогруппе с антигеннородственными мембранными G-белками-гемагглютининами, а также IRKV, уже продемонстрировавших свой нозогенный потенциал для нерезервуарных млекопитающих, эффективны биопрепараты, применяемые в стандартной практике антирабической постконтактной профилактики классического бешенства (иммуноглобулины и вакцины) [18, 19].


