В настоящее время Российская Федерация не может быть отнесена к наиболее благополучным регионам мира по уровню смертности новорожденных. Так, по данным Межведомственной группы Организации Объединенных Наций (The United Nations Inter-agency Group for Child Mortality Estimation), в 2011 г. среди европейских стран по показателю детской смертности (число умерших на 1000 родившихся) Россия занимала одно из последних мест – 40-е из 47 по списку [1]. И хотя в последние годы в нашей стране наметилась устойчивая тенденция к улучшению этой ситуации, проблемы охраны материнства и детства еще далеки от разрешения.
Одной из очевидных причин ранней смертности новорожденных или формирования инвалидности с детства является развитие у беременных внутриутробных инфекций (ВУИ), особенно инфекций TORCH-группы [2, 3]. В связи с несомненной медико-социальной значимостью ВУИ представлятся чрезвычайно важными организация и систематическое осуществление эпидемиологического контроля (мониторинга) за распространением этих инфекций в разных регионах Российской Федерации [4].
Принятый в настоящее время в официальной государственной медицинской статистике принцип учёта заболеваемости по регистрации идентифицированных манифестных случаев каждого заболевания оставляет без внимания значительную массу эпизодов инфицирования этими возбудителями, проходящих бессимптомно или не идентифицируемых по их клиническим проявлениям.

В то же время прогноз и исход заражения женщин патогенами TORCH-группы в плане последствий для текущей беременности и здоровья плода (новорожденного) зачастую не связаны с наличием или отсутствием клинических проявлений этих заболеваний, так как частота поражения и реальная опасность повреждения плаценты и тканей плода не снижаются при малосимптомных вариантах или при полном отсутствии клинических проявлений [2, 3]. Для оценки реальной опасности инфекций TORCH-группы необходима оценка информации не только о частоте регистрации новых манифестных случаев заболеваний (заболеваемость), но и в существенно большей степени – об инфицированнности контингентов, входящих в группы риска, к которым относятся беременные; женщины, планирующие беременность; их сексуальные партнеры; новорожденные, а также дети в возрасте до 1 года. Эту информацию могут обеспечить только периодические медицинские обследования групп риска с лабораторным выявлением маркёров активно текущей или имевшейся в анамнезе инфекции. К числу таких лабораторных методик относится иммуноферментный анализ (ИФА) с выявлением в крови пациента специфических антител классов М и G к иммунодоминантным антигенам соответствующих возбудителей.
В настоящее время клинические лаборатории медицинских организаций Российской Федерации располагают необходимой номенклатурой доступных иммунохимических диагностических средств, в том числе отечественного производства [5–9], что объясняет рост научного интереса и появление в последние годы отдельных научных публикаций, посвященных изучению гуморального иммунитета в отношении возбудителей инфекций TORCH-группы [4].
При этом обращает на себя внимание тот факт, что, несмотря на наличие разработанной нормативной базы по видам и срокам обследования беременных в виде соответствующих приказов Минздрава России [10], целостной функционирующей системы эпидемиологического надзора, включающего изучение лабораторных показателей инфицированности населения возбудителями заболеваний TORCH- группы в разных возрастных и гендерных группах, еще не создано.
Цель настоящего исследования состояла в оценке частоты выявления специфических антител (иммуноглобулинов) классов М (IgM) и G (IgG) к антигенам основных возбудителей инфекций TORCH-группы: Toxoplasma gondii, цитомегаловирусу (ЦМВ), вирусам краснухи, простого герпеса первого (ВПГ- 1) и второго (ВПГ-2) типа с целью изучения особенностей распространения указанных возбудителей среди населения разных регионов России.
Материалы и методы
Исследования были организованы и проведены отделом перспективных разработок производственного предприятия ЗАО «ЭКОлаб» (г. Электрогорск Московской области) на базе Самарского, Калужского и Липецкого областных центров по профилактике и борьбе со СПИД и инфекционными заболеваниями. Группу обследованных составили 89 089 пациентов, проходивших диагностическое или плановое обследование в указанных медицинских организациях в 2008–2013 гг. без ограничений по полу и возрасту. Определение специфических IgM и IgG, а также авидности антител класса G к антигенам возбудителей инфекций TORCH-группы (в соответствии со стандартами обследования, принятыми в каждом регионе) проводили методом ИФА с использованием диагностических наборов реагентов производства ЗАО «ЭКОлаб», разрешенными к применению в Российской Федерации (с клинической чувствительностью и специфичностью по 100%). Всего было выполнено более 564 364 лабораторных исследования.
Результаты и обсуждение
Сводные данные по количеству проведенных в каждом регионе диагностических исследований и числу полученных при этом положительных результатов приведены в табл. 1.
Как следует из представленных данных, стандарты обследования с определением специфических IgM и IgG к Toxoplasma gondii и IgG к ЦМВ приняты во всех трех участвовавших в исследовании регионах, в то время как выявление специфических антител к ВПГ-1 и ВПГ-2 проводится только в Липецкой и Самарской областях, а в отношении вируса краснухи – только в Липецкой и Калужской областях. Целесообразно унифицировать комплекс выполняемых исследований при обследовании целевых групп населения по мере роста экономических возможностей регионов Российской Федерации.
Результаты проведенных исследований показали также, что наиболее часто у обследованных лиц выявляли IgG к ВПГ-1 – в 89,3% (88,4–94,3%) случаев, вирусу краснухи – в 85,8% (82,0–87,4%) и ЦМВ – в 77,1% (41,3–97,1%), в то время как частота определения специфических IgG к T. gondii составляла 41,7% (36,1–45,7%), а к ВПГ-2 – 16,1% (10,4–49,2%). Полученные данные коррелировали с результатами обследования женщин в I–III триместрах беременности, проведенного в Санкт-Петербурге в 2010–2013 гг., согласно которым специфические IgG к ВПГ-1 определялись у 90% обследованных, к вирусу краснухи – у 87,5%, к ЦМВ – у 85% и к T. gondii - у 45% [4].
Установленные величины отражали высокие уровни инфицирования населения обследованных регионов России ВПГ-1 и ЦМВ, что соответствует максимальным показателям распространенности этих инфекций в мире. Инфицированность населения ВПГ-1 во многих странах мира составляет 90–95%, в Европе – 50–80%, в Азии достигает 90–100% [11–13], а показатель инфицированности ЦМВ в разных группах населения Европы, Азии, Америки и Африки (по данным ВОЗ) варьирует от 40 до 100% [13–16]. Необходимо учитывать, что у подавляющего большинства обследованных циркуляция в крови IgG к вирусу краснухи связана, прежде всего, с проведением соответствующей вакцинации по Национальному календарю прививок, а также является следствием ранее перенесенной активной инфекции.
Процент лиц, у которых в ходе обследования были выявлены IgG к T. gondii (41,7%) и ВПГ-2 (16,1%), соответствует скорее средним мировым показателям. Так, по данным ВОЗ, в мире общее число людей, инвазированных токсоплазмами, превышает 1,5 млрд человек, причем на разных территориях этот показатель колеблется от 14 до 90%, составляя в среднем не менее 35%. Минимальная пораженность населения токсоплазмозом (14%) отмечается в странах Северной Европы; средняя (на уровне 25–35%) – в Новой Зеландии, Великобритании и Австралии и высокая (более 50%) – в странах Азии, Африки, Америки и Европы. Об этом свидетельствуют и результаты серологического обследования населения ряда стран Азии и Западной Европы, установившие высокий процент (60–90%) лиц с антителами к токсоплазме [1, 17–19].
Инфицированность населения ВПГ-2 по сравнению к другим возбудителями инфекций TORCH-группы существенно ниже. В странах Европы специфические антитела к ВПГ-2 выявляются у 10–20% лиц во всех группах населения, в Америке – у 13–40%, в африканских странах – у 30–40% жителей. [20]. Доля населения, инфицированного ВПГ-2, зависит от социально-экономического статуса обследуемых контингентов: она увеличивается с возрастом и коррелирует с количеством половых партнёров. Так, у учащихся колледжей антитела к ВПГ-2 выявляются в 4% случаев, у студентов университетов – в 9%, у представителей средних слоев общества – в 25%, среди гомосексуалов и лесбиянок – в 46%, среди проституток – в 70–80% [21].
В проведенном исследовании не было установлено статистически достоверных различий в частоте выявления специфических IgG в качестве показателей общей инфицированности популяции в отношении возбудителей токсоплазмоза, краснухи и ВПГ-1. В то же время были выявлены значимые отличия по уровням выявления IgG к ЦМВ: минимальные показатели (41,3%) – в Калужской области, высокие (80,1%) – в Липецкой и максимальные (97,1%) – в Самарской; различие между минимальными–высокими и манимальными–максимальными уровнями составило 1,94 и 2,35 раза соответственно (вероятность неслучайного характера – не менее 0,99). В отношении антител класса G к ВПГ-2 перепад показателей инфицированности был более выраженным: в Липецкой области положительные результаты были получены в 10,4% случаев, а в Самарской – в 49,1% (различие в 4,72 раза; p < 0,99).
Таким образом, полученные данные не позволили отнести обследованные регионы к числу наиболее благополучных по уровню распространения возбудителей инфекций TORCH-группы. Для определения причин выявленного эпидемиологического неблагополучия в этих регионах необходимо продолжить мониторинг с серологическим обследованием населения, а также провести анализ показателей заболеваемости в разных группах населения. Установленная высокая распространенность возбудителей инфекций TORCH-группы создает потенциальную опасность первичного инфицирования ранее не болевших лиц или реинфекции у людей со сниженными показателями иммунитета, в том числе у беременных, особенно на ранних сроках гестации, что особенно опасно для здоровья матери и плода.
 Как известно, определение специфических IgM к антигенам патогенов является прямым свидетельством активно текущего инфекционного процесса. В этой связи существенным является тот факт, что антитела указанного класса к T. gondii были выявлены у 2,4% (1,2–2,6%) обследованных, к вирусу краснухи – у 0,55% (0,5–0,6%), к ЦМВ – у 2,5% (0,5–14,0%), к ВПГ-1 и ВПГ-2 – у 7,6% (6,6–13,5%) пациентов. Всего по отношению к перечисленным возбудителям инфекций TORCH-группы антитела класса М были определены в 4,0% проведенных исследований (в 9 084 из 228 198 случаев).
Как известно, определение специфических IgM к антигенам патогенов является прямым свидетельством активно текущего инфекционного процесса. В этой связи существенным является тот факт, что антитела указанного класса к T. gondii были выявлены у 2,4% (1,2–2,6%) обследованных, к вирусу краснухи – у 0,55% (0,5–0,6%), к ЦМВ – у 2,5% (0,5–14,0%), к ВПГ-1 и ВПГ-2 – у 7,6% (6,6–13,5%) пациентов. Всего по отношению к перечисленным возбудителям инфекций TORCH-группы антитела класса М были определены в 4,0% проведенных исследований (в 9 084 из 228 198 случаев).
В обследованных регионах России беременные составили от 33 до 83% от общего числа лиц с наличием специфических IgM к возбудителям инфекций TORCH-группы, а новорожденные – 0,2 и 1,2% среди лиц с IgM к T. gondii и ВПГ-1,2 соответственно. Определение высоких показателей активности инфекционного процесса заболеваний TORCH-группы у беременных и новорожденных диктует необходимость более активного осуществления мероприятий по серологическому контролю и предотвращению распространения этих инфекций в указанных группах, на что обращают внимание и другие авторы [4].
При сопоставлении полученных данных был отмечен относительно низкий уровень выявления IgM к вирусу краснухи и отсутствие статистически достоверных различий этого показателя по обследованным регионам России, что, в определенной степени, является отражением реализации мероприятий по вакцинации населения.
В этой связи становится более понятными расхождения в частоте выявления IgM к вирусу краснухи в популяции (в среднем – 0,55%) по сравнению с данными официальной статистической отчетности Минздрава России по заболеваемости населения этой инфекцией (в 2011 г. – 0,23 случая на 100 тыс. населения, что соответствует лишь 0,00023%) [22]. Такие различия диктуют целесообразность оптимизации системы эпидемиологического контроля над распространением указанной инфекции, а также сроков и периодичности проведения иммунизации с учетом мониторинга результатов лабораторных обследований разных групп населения.
В то же время у жителей разных регионов страны установлены более высокие и существенно различающиеся между собой уровни выявления специфических IgM к другим патогенам. Так, частота определения IgM к T. gondii у жителей Липецкой и Калужской областей превышала соответствующий показатель для Самарской области в 1,08 и 2,19 раза соответственно (с вероятностью не менее 0,95). Выявление антител класса М к ЦМВ в Самарской области было выше, чем в Липецкой в 28 раз, а к ВПГ-1,2 – в 2,05 раза (вероятность неслучайного характера выше 0,999).
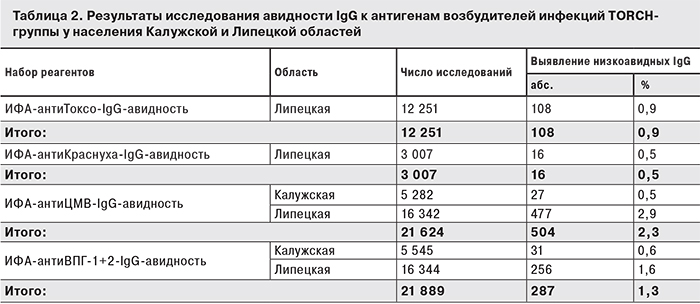
Дополнительным лабораторным свидетельством активно текущего характера инфекции или недавних сроков инфицирования принято считать низкую авидность IgG к антигенам соответствующего возбудителя. Из общего числа образцов, в которых были выявлены IgG к возбудителям инфекций TORCH-группы, доля проб с низкоавидными IgG к T. gondii составила 0,9%, к вирусу краснухи – 0,5%, к ВПГ-1,2 – 1,3% и к ЦМВ – 2,3% случаев. Сводные данные представлены в табл. 2.
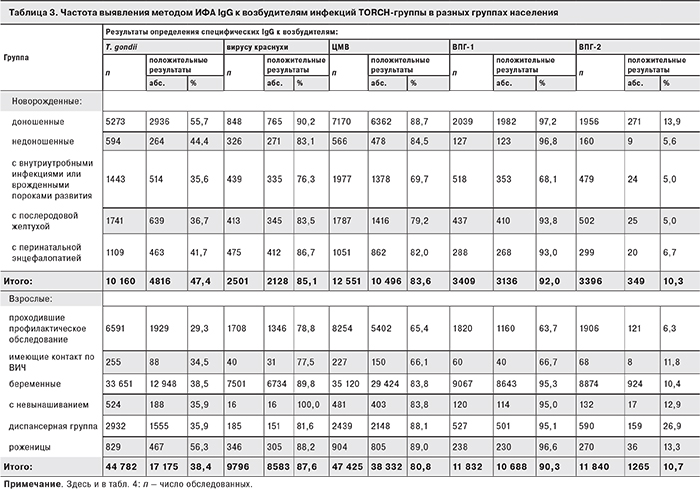
Следует отметить, что при сопоставлении полученных показателей по годам проведения настоящего исследования существенных и статистически значимых различий выявить не удалось. При сравнении результатов в разных группах обследованных эти показатели в ряде случаев существенно отличались. В табл. 3 приведены данные, полученные на базе Липецкого центра, для наиболее представительных по численности групп с разными клиническими диагнозами. Как следует из табл. 3, частота выявления IgG к T. gondii колебалась от 29,3 до 56,3%, к вирусу краснухи – от 77,5 до 100%, к ЦМВ – от 65,4 до 89,0%, к ВПГ-1 – от 63,7 до 97,2% и к ВПГ-2 – от 5,0 до 26,9%.
При этом частота определения специфических IgG к антигенам возбудителей инфекций TORCH-группы у рожениц и новорожденных была максимальной в каждой группе, а сами значения относительных показателей были очень близки, что обусловлено природной способностью трансплацентарного переноса антител этого класса от больной материи в кровоток плода. Наиболее низкие показатели выявления специфических IgG к возбудителям инфекций TORCH-группы, как ни странно, наблюдали у новорожденных с диагнозами «внутриутробные инфекции, врожденные пороки развития» и «послеродовая желтуха», а у взрослых – среди лиц, проходивших профилактическое обследование, или имевших контакт по ВИЧ.
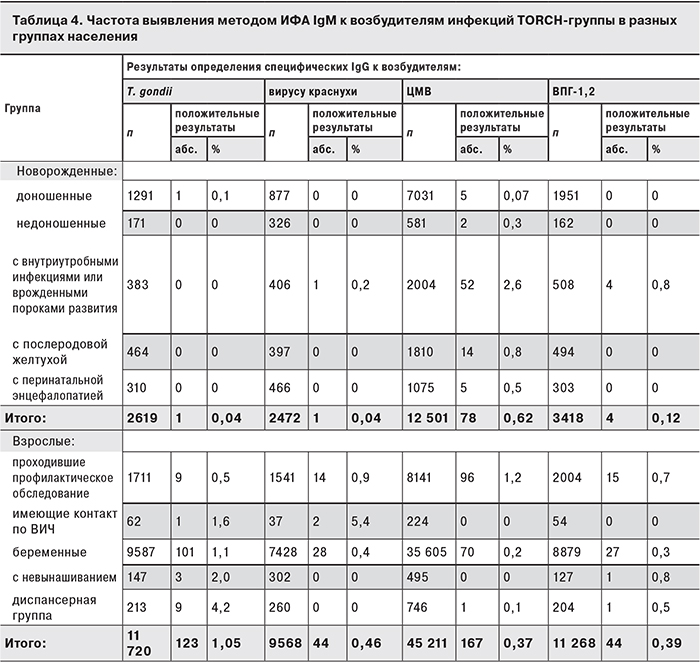
Частота определения IgM к T. gondii колебалась в диапазоне 0–4,2%, к вирусу краснухи – 0–5,4%, к ЦМВ – 0–2,6 % и к ВПГ-1,2 – 0–0,8%. В группе новорожденных наиболее существенные результаты были получены в отношении инфицирования ЦМВ – 0,62%, тогда как IgМ в отношении других возбудителей инфекций TORCH-группы выявлялись в единичных случаях, что делает малоинформативным подсчет относительных показателей и их сопоставление.
Среди взрослых специфические IgM в отношении большинства изучаемых патогенов наиболее часто определялись при проведении профилактических обследований, у лиц, контактных по ВИЧ, и у беременных, в то время как по отношению к антигенам T. gondii – практически во всех выделенных подгруппах.
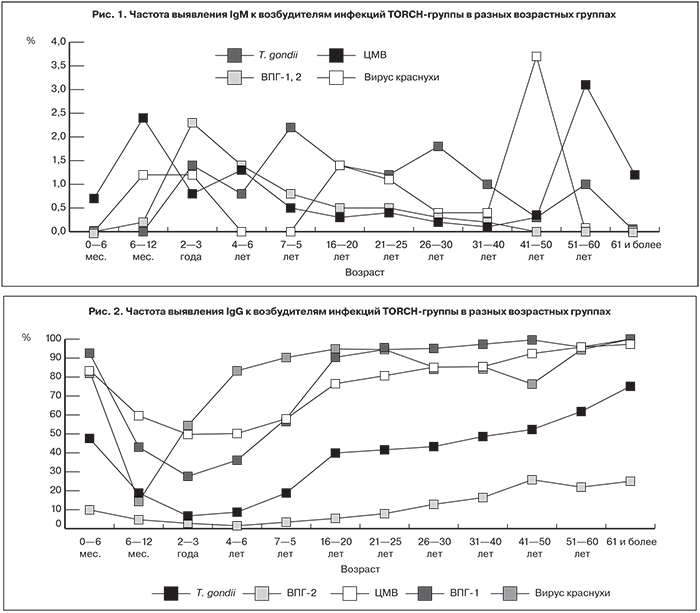
Полученные в настоящем исследовании данные позволили также оценить динамику частоты выявления специфических антител обоих классов к антигенам возбудителей инфекций TORCH-группы в зависимости от возраста обследованных. Результаты представлены на рис. 1 и 2.
Анализ полученных данных позволил определить, что в результате внутриутробного заражения специфические IgM к возбудителям инфекций TORCH-группы выявляются в крови даже у новорожденных: к ЦМВ – с частотой 0,07%, к T. gondii – 0,04%, а в отношении вируса краснухи и ВПГ-1,2 еще реже. В течение первых трех лет жизни частота определения указанных антител достигает возрастного максимума, затем несколько понижается, подвергаясь вариативным колебаниям в течение дальнейшей жизни. При некоторых инфекциях наблюдаются пиковые повышения частоты выявления специфических IgM: к T. gondii – в возрасте 7–15, 26–30 лет и от 51 года до 60 лет; к вирусу краснухи – в возрасте 16–25 лет и от 41 года до 50 лет; к ЦМВ – в возрасте 4–6 лет и от 51 года до 60 лет. Характерное повышение частоты развития острых инфекций, вызываемых вирусами краснухи, ЦМВ и T. gondii, в возрастных группах от 41 года до 50 лет и от 51 года до 60 лет, по-видимому, обусловлено естественным постепенным снижением приобретенного гуморального иммунитета за счет уменьшения клеток иммунной памяти и реинфекции указанными возбудителями при контакте с окружающими детьми (внуками) или больными людьми.
Довольно высокая частота выявления специфических IgG к основным возбудителям инфекций TORCH-группы (T. gondii, вирусу краснухи, ЦМВ, ВПГ-1 и ВПГ-2) в первые 6 месяцев жизни ребенка, соответствующая частоте их определения в репродуктивном возрасте (16–40 лет), объясняется наличием в крови новорожденного соответствующих материнских антител, которые затем постепенно элиминируют к возрасту 6–12 мес. Последующее инфицирование (вакцинация ребенка против краснухи и естественный механизм инфицирования T. gondii, ЦМВ и ВПГ) приводит к активации у детей и взрослых собственного гуморального иммунитета; частота определения специфических IgG к возбудителям изучаемой группы нарастает быстрее в возрасте 2–20 лет, а в последующие годы жизни – несколько медленнее. Частота выявления IgG к вирусу краснухи постепенно понижается к возрасту от 41 года до 50 лет, что приводит к реинфекции краснухи и соответствующему пику определения IgM в этой возрастной группе (см. рис. 1). В отношении ВПГ-1 и ВПГ-2 также отмечается некоторое снижение частоты определения специфических IgG в возрастной группе от 51 года до 60 лет, что, однако, не нашло отражения в изменении частоты выявления соответствующих IgM.
Определенные различия в интенсивности нарастания показателей выявления специфических IgG объясняются, по-видимому, особенностями циркуляции этих возбудителей в популяции, обусловленными путями их передачи от инфицированного человека здоровому (преобладание воздушно-капельного, контактного или полового пути). Все выявленные тренды не случайны с вероятностью более 0,999.
Результаты лабораторных исследований также позволили оценить распределение концентраций специфических IgG к вирусу краснухи в крови у обследованных (рис. 3).
Было установлено, что в 24,6% случаев содержание IgG к вирусу краснухи в крови было ниже защитного уровня в 25 МЕ/мл, установленного для России в соответствии со специально выполненными исследованиями [23, 24]. Необходимо также учитывать, что у 14,2% обследованных эти антитела не были выявлены вовсе. Представленные данные наглядно показывают, что, несмотря на расширенную программу иммунизации против краснухи, доля лиц, не защищенных от последующего заражения этим патогеном, остается достаточно большой, чтобы привлечь к этому вопросу внимание соответствующих медицинских служб.
Выводы
- Эпидемиологический надзор над распространением инфекций TORCH-группы в Российской Федерации нуждается в стандартизации серологического обследования населения с определением маркеров гуморального иммунитета ко всем основным возбудителям инфекций этой группы, что может быть использовано также для централизованного мониторинга показателей популяционного иммунитета у населения.
- В результате проведенного лабораторного обследования с выявлением маркеров инфицированности населения возбудителями инфекций TORCH-группы установлено, что 3 региона Российской Федерации (Калужская, Липецкая и Самарская области) по показателю распространенности ЦМВ и ВПГ-1 соответствуют наименее благополучным регионам мира, а по распространенности T. gondii и ВПГ-2 – регионам со средними показателями. При этом уровни инфицированности населения разных регионов России возбудителями инфекций TORCH-группы подвержены существенным вариативным колебаниям.
- Несмотря на проведение массовой вакцинации, до 14,2% (12,6–18,0%) населения обследованных регионов России не имеют серологических маркеров приобретенного иммунитета по отношению к вирусу краснухи, при этом среди лиц с выявленными в крови специфическими IgG к вирусу краснухи доля лиц, у которых концентрация этих антител ниже защитного уровня, достигает 24,6%, что создает реальную опасность их последующего инфицирования.


