Туберкулез человека – широко распространенное в мире инфекционное заболевание. Развитие различных его видов и форм, включая наиболее опасную – легочную, обусловлено группой близкородственных видов микобактерий Mycobacterium tuberculosis complex (МТВС). Она представлена M. tuberculosis, M. bovis, M. africanum, M. canettii, M. microti, M. pinnipedii и M. capraе [1]. Микобактерии, входящие в эту группу и способные вызывать у человека туберкулез, объединены высокой (порядка 99,9%) степенью генетического родства и идентичны по последовательностям 16S pРНК. Как показали исследования, MTBC имеет в последние годы весьма отчетливую тенденцию к увеличению за счет появления новых лекарственно устойчивых и атипичных форм микобактерий. В России, как правило, это происходит в связи с легальной и нелегальной трудовой миграцией, появлением десятков тысяч людей в разных регионах нашей страны, а также включением в состав РФ новых территорий (Крым).
Несмотря на позитивную динамику снижения заболеваемости туберкулезом в России после 2010 г., которую подтверждают статистические показатели (к началу 2011 г. общая заболеваемость туберкулезом снизилась на 5,1%, а распространенность – на 5,3%), ВОЗ относит Российскую Федерацию к странам с неблагополучной эпидемической ситуацией по туберкулезу наряду со странами Африки, Бразилией и Афганистаном. Поэтому проблема туберкулеза остается весьма и весьма актуальной.
Как известно, наиболее эффективное лечение туберкулеза наступает при ранней диагностике, когда не в полной мере нарушены защитные силы организма больного человека и само лечение не требует длительного времени и продолжительного приема лекарственных препаратов.
 Важной особенностью ранней диагностики является то, что первичное инфицирование возбудителем туберкулеза наиболее часто происходит у детей в возрасте от 3 до 6 лет. Именно в этот период организм ребенка встречается с микобактериями, и в результате течения туберкулезной инфекции возникают следующие варианты: полная элиминация микобактерий туберкулеза; состояние инфицирования без клинических проявлений заболевания; возникновение активного туберкулеза; неактивные посттуберкулезные изменения различной степени выраженности в результате клинического излечения активных форм туберкулеза (либо самопроизвольного, либо после специфического лечения); хроническое течение заболевания с периодами обострений, ремиссий и неуклонным прогрессированием; острое прогрессирование заболевания с летальным исходом.
Важной особенностью ранней диагностики является то, что первичное инфицирование возбудителем туберкулеза наиболее часто происходит у детей в возрасте от 3 до 6 лет. Именно в этот период организм ребенка встречается с микобактериями, и в результате течения туберкулезной инфекции возникают следующие варианты: полная элиминация микобактерий туберкулеза; состояние инфицирования без клинических проявлений заболевания; возникновение активного туберкулеза; неактивные посттуберкулезные изменения различной степени выраженности в результате клинического излечения активных форм туберкулеза (либо самопроизвольного, либо после специфического лечения); хроническое течение заболевания с периодами обострений, ремиссий и неуклонным прогрессированием; острое прогрессирование заболевания с летальным исходом.
С целью раннего предотвращения заболевания туберкулезом в нашей стране с 1952 г. (утвержден ВОЗ международный стандарт использования сухого очищенного туберкулина – PPD-S), а затем с 1953 г. (утвержден национальный стандарт использования сухого очищенного туберкулина – PPD-L) стала использоваться массовая туберкулинодиагностика. До сегодняшнего дня основным методом массового обследования инфицированности населения на заболеваемость туберкулезом, согласно «Инструкции по применению аллергена туберкулезного очищенного» [2, 3], является стандартизированная внутрикожная туберкулиновая проба с аллергеном туберкулезным, содержащим 2 туберкулиновые единицы (ТЕ) очищенного туберкулина в стандартном разведении.
Так что же за препарат мы используем более 60 лет и стоит ли заменять (дополнять) его другими, современными, например, диаскинтестом?
Туберкулин был открыт в 1890 г. немецким ученым Робертом Кохом. В 1907 г. австрийский педиатр Клеменс Пирке обосновал специфичность туберкулиновой пробы и ввёл в медицину понятия «аллергия» и «скарификационная кожная проба». Через год Шарль Манту предложил применять туберкулин внутрикожно с диагностической целью (проба Манту). За прошедшие десятилетия использования туберкулина в большинстве европейских стран, США, да и во всем мире под руководством ВОЗ была показана как его безусловная эффективность в диагностике различных стадий инфицированности и заболевания туберкулезом населения, так и, к сожалению, большое количество ложноположительных результатов.
В настоящее время производятся в основном очищенный стандартный туберкулин Зейберта (PPD-S), очищенный стандартный туберкулин Линниковой (PPD-L) и PPD (Purified Protein Derivative) – очищенный белковый дериват. С чем связана чувствительность и специфичность туберкулина?
Туберкулин – неполный антиген (гаптен) микобактерий туберкулеза, PPD, смесь фильтратов убитых нагреванием культур микобактерий туберкулеза человеческого и бычьего видов. Вот далеко не полный перечень названий абсолютно конкретного вещества, вводимого в организм человека и обладающего высокой биологической активностью, то есть способностью вызывать у вакцинированных живой вакциной БЦЖ (M. bovis), инфицированных и больных туберкулезом людей гиперчувствительность замедленного типа (ГЗТ). При внутрикожном применении туберкулезного аллергена в концентрации 2 ТЕ в стандартном разведении развивается специфическая реакция (в виде папулы и гиперемии), учет которой производят через 24–72 ч. Перерасчет массы сухого очищенного туберкулина PPD-L (по национальному стандарту) в единицы туберкулиновой активности дает нам соответствие 1 ТЕ = 0,00006 мг или 0,06 мкг. Таким образом, каждому человеку при диагностике туберкулеза вводят 0,12 мкг вещества.
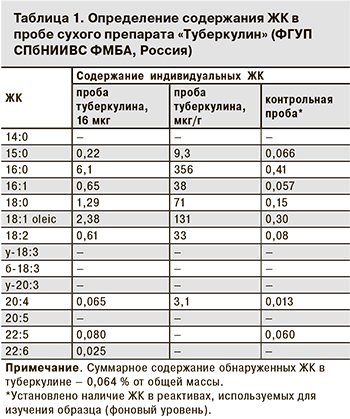
Что представляет собой субстанция туберкулина, которую на протяжении десятков лет очищали от примесей, совершенствуя технологию? Анализ технического регламента показывает, что туберкулином называют смесь секретируемых патогенными микобактериями двух видов (M. tuberculosis и M. bovis) в синтетическую питательную среду гликозилированных и негликозилированных белков и их комплексов. Изучение проб сухого препарата «Туберкулин» для накожного, подкожного и внутрикожного применения показало присутствие в аналитических количествах липидов (табл. 1). 75% всех жирных кислот (ЖК) составляют производные пальмитиновой (16:0) и в значительно меньшей степени – олеиновой (18:0) кислот. Наиболее изученная группа гликолипидов – трегалозосодержащие гликолипиды [2,3-диацилтрегалоза (ДАТ), 2,3,6-триацилтрегалоза (ТАТ) и др.] и липоарабиноманнан являются составляющими клеточной стенки патогенных микобактерий, а она (как и сами микобактерии) в синтетической среде при получении туберкулина отсутствует.

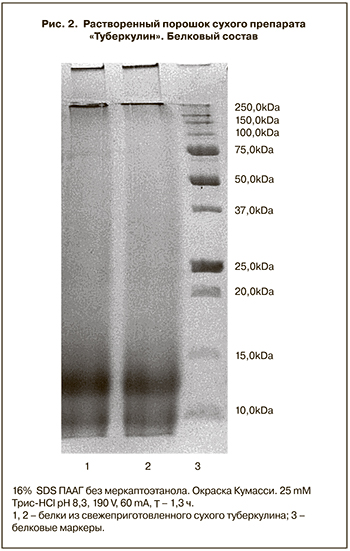
Какие из известных секретируемых гликозилированных и негликозилированных белков представлены в туберкулине? На этот вопрос можно ответить коротко – все! Анализ по Лэмли в 16% ПААГ секретируемых микобактериальных белков, которые получают из концентрированной синтетической питательной среды после полного удаления из нее выросшей биологической массы двух видов микобактерий, в зависимости от способа их осаждения (высаливание сульфатом аммония или осаждение 50% трихлоруксусной кислотой) показывает полный спектр белков от 6,0 до 150,0 kDa и выше. Это специфические антигены ESAT6, CFP10, Ag85A, Ag85B, Ag85C, Ag85D и др. (табл. 2) [4, 5]. Эти белки относятся к факторам вирулентности MTBC, обладают высокой перекрестной реактивностью с антигенами практически всех патогенных микобактерий, являются основной антигенной фракцией фильтрата культур (рис. 1 А, Б ).
Дальнейшая многократная обработка полученных из фильтрата синтетической среды туберкулезных белков и их гликозилированных комплексов этанолом и медицинским эфиром приводит к переходу (фрагментации) высокомолекулярных соединений в низкомолекулярные. В конечном итоге электрофорез в 16% ПААГ очищенного сухого туберкулина для инъекций показывает наличие только низкомолекулярных фракций белков в интервале 6,0–15,0 kDa. Эти белки (пептиды) не обладают выраженной антигенной (иммуногенной) активностью в силу небольшой молекулярной массы и наличия полисахаридов (расчеты показывают, что количество полисахаридов в очищенном сухом туберкулине может достигать 20%). В то же время эти белки (пептиды) обладают очень высокой способностью вызывать реакции ГЗТ, то есть выявлять в организме человека наличие клеточного иммунитета к патогенным микобактериям (рис. 2).
 Эти научные и литературные данные по составу фрагментов отдельных белков и гликопротеинов очищенного сухого туберкулина позволяют нам объяснить причины проявления ГЗТ у пациентов, которые инфицированы одним из видов микобактерий, входящих в группу MTBC, являющихся лекарственно устойчивыми, атипичными и/или близкородственными. То есть туберкулин – это диагностикум широкого спектра, не пропускающий инфицированных микобактериями пациентов. Это очевидный плюс, однако есть и недостатки, связанные с неспецифической туберкулиновой реакцией. Положительная неспецифическая туберкулиновая реакция возможна у пациентов после перенесенных заболеваний, вызванных микроорганизмами или вирусами, синтезирующими похожие по структуре и свойствам белки, которые есть у микобактерий M. tuberculosis и M. bovis, или при наличии сопутствующих заболеваний; у людей с повышенной гиперреактивностью на чужеродный белок и по ряду других причин, связанных с индивидуальными особенностями организма и/или наличием иных приобретенных внешних факторов. Эти недостатки снижают информативность данного метода диагностики туберкулеза, одновременно стимулируя исследования по созданию лучшего препарата, например, получение нового модифицированного туберкулина (PPD-M) из фильтрата синтетической среды, на которой выращивали только один вирулентный штамм M. tuberculosis или два, но одного вида M. tuberculosis. PPD-M – это смесь очищенных от питательной среды секретируемых низкомолекулярных гликозилированных и негликозилированных белков одного вида патогенных микобактерий – M. tuberculosis, сохраняющих все свойства традиционного туберкулина, но лишенного балластных белков M. bovis (которые не участвуют в ГЗТ, но могут быть аллергенами), Предполагается, что PPD-M сохранит широкий спектр туберкулинодиагностики, так как содержит в своем составе все белковые факторы вирулентности (см. табл. 2) при заметном снижении неспецифических аллергических реакций (ложноположительных реакций) и уменьшении антигенной нагрузки при введении в организм диагностической пробы, содержащей 2 ТЕ.
Эти научные и литературные данные по составу фрагментов отдельных белков и гликопротеинов очищенного сухого туберкулина позволяют нам объяснить причины проявления ГЗТ у пациентов, которые инфицированы одним из видов микобактерий, входящих в группу MTBC, являющихся лекарственно устойчивыми, атипичными и/или близкородственными. То есть туберкулин – это диагностикум широкого спектра, не пропускающий инфицированных микобактериями пациентов. Это очевидный плюс, однако есть и недостатки, связанные с неспецифической туберкулиновой реакцией. Положительная неспецифическая туберкулиновая реакция возможна у пациентов после перенесенных заболеваний, вызванных микроорганизмами или вирусами, синтезирующими похожие по структуре и свойствам белки, которые есть у микобактерий M. tuberculosis и M. bovis, или при наличии сопутствующих заболеваний; у людей с повышенной гиперреактивностью на чужеродный белок и по ряду других причин, связанных с индивидуальными особенностями организма и/или наличием иных приобретенных внешних факторов. Эти недостатки снижают информативность данного метода диагностики туберкулеза, одновременно стимулируя исследования по созданию лучшего препарата, например, получение нового модифицированного туберкулина (PPD-M) из фильтрата синтетической среды, на которой выращивали только один вирулентный штамм M. tuberculosis или два, но одного вида M. tuberculosis. PPD-M – это смесь очищенных от питательной среды секретируемых низкомолекулярных гликозилированных и негликозилированных белков одного вида патогенных микобактерий – M. tuberculosis, сохраняющих все свойства традиционного туберкулина, но лишенного балластных белков M. bovis (которые не участвуют в ГЗТ, но могут быть аллергенами), Предполагается, что PPD-M сохранит широкий спектр туберкулинодиагностики, так как содержит в своем составе все белковые факторы вирулентности (см. табл. 2) при заметном снижении неспецифических аллергических реакций (ложноположительных реакций) и уменьшении антигенной нагрузки при введении в организм диагностической пробы, содержащей 2 ТЕ.
Возможно получение хроматографически чистого туберкулина (PPD-X), который также будет смесью секретируемых низкомолекулярных гликозилированных и негликозилированных пептидов, полученных из патогенных микобактерий M. tuberculosis с помощью колоночной хроматографии, максимально очищенной от балластных белков, полисахаридов и липидов, которые не участвуют в реакциях ГЗТ. Этот препарат будет содержать весь набор секретируемых микобактериями видоспецифических белков, относящихся к факторам вирулентности, что позволит сохранить широкий спектр туберкулинодиагностики на группу MTBC. При этом могут быть максимально снижены неспецифические аллергические реакции и уменьшено количество вводимого в организм препарата.
«Диаскинтест® — инновационный внутрикожный диагностический тест, который представляет собой рекомбинантный белок, содержащий два связанных между собой антигена – ESAT6 и CFP10, характерных для вирулентных штаммов микобактерий туберкулеза (M. tuberculosis и M. bovis). Данные антигены отсутствуют в вакцинном штамме M. bovis БЦЖ и у большинства нетуберкулезных микобактерий… Благодаря данным качествам диаскинтест® обладает практически 100% чувствительностью и специфичностью, сводя к минимуму вероятность развития ложноположительных реакций» [6].
Так что же представляет собой диагностикум как биологически активная субстанция? Это синтетические белки ESAT6 и CFP10, которые были открыты и изучены как гликопептиды с молекулярной массой 6,0 и 10,0 kDa соответственно более 17 лет назад [7–10], или это один химерный гибридный белок, содержащий два связанных пептида? Ответ на этот вопрос содержится в патенте РФ № 2277540 от 10.06.2006 «Способ диагностики туберкулезной инфекции, рекомбинантная плазмидная ДНК, кодирующая синтез гибридного белка CFP10-ESAT6 из Mycobacterium tuberculosis, способ его получения, гибридный белок CFP10-ESAT6 и его применение», который с 17.01.13 прекратил свое действие и может рассматриваться как научная публикация [11]. Из анализа этого материала становиться очевидно, что основой диаскинтеста является химерный гибридный белок, включающий только пептидную часть ESAT6 и CFP10, имеющий молекулярную массу 27,0 kDa (?) и получаемый (выделяемый) из генно-инженерного штамма кишечной палочки E. сoli DLT1270.
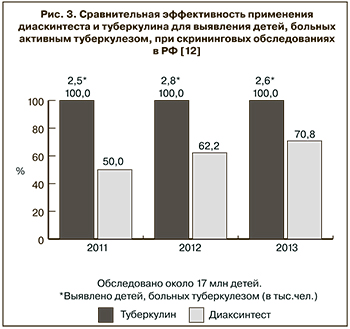
В соответствии с литературными данными, которые приведены в обзоре по факторам вирулентности [4], по крайней мере 11 секретируемых белков патогенных микобактерий относят к факторам вирулентности (см. табл. 2). Из них диаскинтест содержит только два, в то же время туберкулин имеет практически весь комплекс выявленных антигенов. Это позволяет ему определять более широкий спектр, включая атипичные штаммы микобактерий, штаммы с множественной (МЛУ) и широкой лекарственной устойчивостью (ШЛУ) (рис. 3). На это указывает и статистика по диагностике туберкулеза [12–17].
 Идентичность способов введения обоих препаратов и время учета результата постановки пробы позволяют затронуть вопрос об антигенной нагрузке на организм человека. По разным данным, активность гибридного белка диаскинтеста проявляется при введении внутрикожно в дозе 0,2 мкг, в то время как 1 ТЕ составляет 0,06 мкг субстанции, что в 3 раза меньше. А чем меньше вводимая доза препарата, тем менее вероятна возможная аллергизация организма при повторных процедурах. Причем у туберкулина есть «светлое будущее». Как известно, по технологии туберкулин получают из синтетической питательной среды, на которой выросла биомасса двух вирулентных микобактерий (M. tuberculosis и M. bovis) в равных условиях. Следовательно, получаемый туберкулин содержит 50% полипептидов M. tuberculosis и 50% полипептидов M. bovis, что в конечном итоге позволяет выявлять заболевание туберкулезом человека от любого патогенного штамма микобактерий. Если есть необходимость определять преимущественно заболевания, вызванные только M. tuberculosis, то туберкулин по отработанной технологии можно получать только из M. tuberculosis.
Идентичность способов введения обоих препаратов и время учета результата постановки пробы позволяют затронуть вопрос об антигенной нагрузке на организм человека. По разным данным, активность гибридного белка диаскинтеста проявляется при введении внутрикожно в дозе 0,2 мкг, в то время как 1 ТЕ составляет 0,06 мкг субстанции, что в 3 раза меньше. А чем меньше вводимая доза препарата, тем менее вероятна возможная аллергизация организма при повторных процедурах. Причем у туберкулина есть «светлое будущее». Как известно, по технологии туберкулин получают из синтетической питательной среды, на которой выросла биомасса двух вирулентных микобактерий (M. tuberculosis и M. bovis) в равных условиях. Следовательно, получаемый туберкулин содержит 50% полипептидов M. tuberculosis и 50% полипептидов M. bovis, что в конечном итоге позволяет выявлять заболевание туберкулезом человека от любого патогенного штамма микобактерий. Если есть необходимость определять преимущественно заболевания, вызванные только M. tuberculosis, то туберкулин по отработанной технологии можно получать только из M. tuberculosis.
Вообще рассуждения о достоинствах и недостатках двух диагностических систем напоминают ситуацию с использованием в медицине антибиотиков, эра которых началась с открытия в 1929 г. Александром Флемингом пенициллина. В 1943 г. Зельман Ваксман совместно с Альбертом Шацем получил стрептомицин – первый противомикробный препарат, который оказывал бактериостатическое действие на микобактерии туберкулёза. Первые антибиотики – пенициллин и стрептомицин – были лекарственными препаратами широкого спектра действия. Позднее появились антибиотики узкого спектра действия, например, макролиды (эритромицин, олеандомицин и т. д.), направленные на лечение инфекций, вызванных только грамположительной патогенной микрофлорой. Оба эти направления в различных модификациях развиваются и сейчас. Врачи понимают, что при невыясненной этиологии инфекционного заболевания необходимо использовать антибиотики широкого спектра действия. При установленном диагнозе и выделенном возбудителе очень эффективны антибиотики узкого спектра действия.
При массовом обследовании населения на возможность инфицирования или заболевания туберкулезом можно только предполагать, какой конкретный вид патогенных микобактерий доминирует в области, республике, районе; есть ли какие-то изменения в его групповой или видовой принадлежности, изменения спектра устойчивости к антибиотикам и т. д. То есть всегда ситуация не ясна до конца, и существует реальная опасность пропустить начало вспышки заболевания. В этих случаях диагностику необходимо проводить с помощью туберкулина. Она покажет реальную картину эпидемиологического состояния. Если ситуация по заболеваемости туберкулезом благополучная или надо показать снижение инфицирования и заболеваемости туберкулезом в том или ином регионе, тогда для диагностики можно использовать только диаскинтест. На его основе можно иметь хорошую статистику, которая, увы, не будет отражать истиной картины.
Диаскинтест внедрен в практику в Российской Федерацией в 2009 г. Благодаря агрессивной рекламе, построенной выпускающей диагностический препарат компанией на противопоставлении «абсолютно нового в мире инновационного продукта с прекрасными свойствами», призванного заменить «плохой, устаревший научно, морально и т. д.» туберкулин, за истекшее время диаскинтест занял большой сектор рынка диагностических препаратов. Но только в России! Ни одна из развитых и развивающихся стран мира не купила права на производство и выпуск «русского чуда» диагностики туберкулеза. Более того, сама кампания-производитель с 17.01.2013 не поддерживает собственный патент. За это же время (с 2006 г.) ни одна страна в мире не перешла полностью на диагностику туберкулеза с помощью гликопептидов ESAT6 и/или CFP10 – основы специфичности и чувствительности химерного генно-инженерного белка диаскинтеста.
Есть и еще одно важное обстоятельство, на котором необходимо остановиться отдельно в связи с призывами полностью заменить туберкулин диаскинтестом. Авторы химерного белка с включенными в его структуру пептидами ESAT6 и CFP10 по сути утверждают, что любая патогенная микобактерия, способная вызвать развитие туберкулезной инфекции у человека, должна синтезировать эти пептиды. То есть для всех MTBC, а также лекарственно устойчивых и атипичных форм (микобактерии с измененной биохимической активностью) эти пептиды должны быть обязательными компонентами фактора их вирулентности. В противном случае, как, например, с БЦЖ, если нет синтеза пептидов, то нет и диагностики туберкулеза с помощью диаскинтеста. В этой связи возникает вопрос: а является ли БЦЖ патогенным штаммом для человека? При определенных обстоятельствах – да, и примером этого является наличие описанных в научной литературе десятков, если не сотен случаев развития туберкулеза у детей после вакцинации БЦЖ. Следовательно, есть исключения, когда патогенность микобактерий возможна без синтеза ESAT6 и CFP10. А если это так, то ранняя диагностика туберкулеза с помощью только диаскинтеста является серьезной ошибкой и не может быть национальным приоритетом в борьбе с туберкулезом.
Изложенные соображения позволяют прийти к выводу, что туберкулин необходимо применять как базовый диагностический препарат, признанный и используемый во всем мире. ВОЗ по настоящее время рекомендует использовать для диагностики туберкулин. Существуют реальные возможности совершенствовать данный диагностический тест путем получения модифицированного (PPD-M) и(или) хроматографически чистого туберкулина (PPD-X).
Диаскинтест требует дальнейшего изучения и совершенствования. К нему необходимо относиться как к экспериментальному препарату, который можно использовать в диагностических целях с большой осторожностью до более полного изучения его свойств и последствий применения. Диаскинтест является перспективным диагностическим препаратом как подтверждающий тест при оценке эффективности лечения больных туберкулезом.


