По данным ВОЗ, пандемия гриппа, вызванная вирусом свиного происхождения A(H1N1)pdm09, перешла в фазу IV в 2011 г., что фактически было равносильно декларации ее завершения. Однако вирус A(H1N1)pdm09 продолжает циркулировать и в настоящее время, вызывая тяжелые случаи заболевания со смертельными исходами. Это стало неожиданностью для практического здравоохранения: на фоне относительно низкой заболеваемости резко возросла частота госпитализаций пациентов с осложненным гриппом [1]. Основная задача здравоохранения в период пандемии – максимальное снижение экономического ущерба от массовой заболеваемости, а также медицинских последствий перенесенного гриппа и смертности. Совершенно очевидно, что, несмотря на все усилия, в период пандемии не удалось в полной мере предупредить смертельные исходы и так называемую отсроченную смертность. Также очевидно, что эти факторы оказывают негативное влияние на демографические процессы.
Поэтому, учитывая особенности эпидемического процесса на территории России, целесообразно провести анализ пандемии гриппа A(H1N1)pdm09 и ближайшего постпандемического периода. Для здравоохранения представляет особую важность объективная оценка и прогнозирование тяжести пандемий [2]. Оценка тяжести пандемии необходима также для понимания влияния массовой заболеваемости на демографическую структуру и показатели здоровья населения. Анализ повышенной чувствительности к гриппозной инфекции свидетельствует о том, что в пределах многонациональной популяции населения существуют субпопуляции, наиболее чувствительные к пандемическим вирусам. Генетические исследования демографических последствий пандемий позволяют понять структуру мер профилактики и защиты на уровне отдельных групп населения и страны в целом.
Известно, что пандемии гриппа развиваются, как правило, в две волны с последующим снижением активности процесса и сменой циркулирующих вирусов [3]. Анализ эпидемических процессов в период с 2009 по 2013 г. показал, что заболеваемость гриппом и ОРВИ, по данным клинической диагностики, снижалась постепенно, что до определенной степени соответствовало снижению уровня циркуляции пандемического вируса A(H1N1)pdm09 [1]. Это также относилось к частоте госпитализаций и показателям смертности. Исключение составила эпидемия 2011/2012 гг., интенсивность которой по некоторым параметрам была ниже, чем в 2009 г. [1]. В этиологической структуре этого периода наблюдения преобладали вирусы гриппа A(H3N2) и В. Пандемический вирус A(H1N1)pdm09 вышел из активной циркуляции.
В первую волну пандемии 2009 г. вирус гриппа А(H1N1)pdm09 распространился по территории России с Дальнего Востока в западном направлении. Следующие волны пандемии 2011 и 2013 гг. характеризовались смешанной этиологией, и вирус пандемического гриппа распространялся по территории России с Европейской части в восточном направлении. В сезон 2011/2012 гг. эпидемия носила смешанный этиологический характер с преимущественной циркуляцией вирусов А(H3N2) и В. В 2012/2013 гг., так же, как в 2009 г., вирус гриппа А(H1N1)pdm09 распространялся с Дальнего Востока. Через 4 нед. он охватил всю территорию Российской Федерации с преимущественной циркуляцией в Сибири [1].
Интенсивность эпидемий по округам зависела от распространения пандемического гриппа по территории России и его вклада в заболеваемость. Наиболее высокие показатели заболеваемости регистрировались на стартовых территориях распространения пандэпидемии, то есть в регионах страны, которые стали «географическими воротами заноса инфекции» на территорию России. Так, при распространении с востока на запад пандемического гриппа А(H1N1)pdm09 максимальные показатели заболеваемости отмечены в Дальневосточном и Сибирском федеральных округах, что было характерно для 2009 и 2013 гг. При распространении эпидемии с запада на восток в 2011 г. заболеваемость была выше в Северо-Западном и Приволжском федеральных округах, в 2013 г. интенсивность эпидемии была выше в Северо-Западном и Уральском округах, а в 2014 г. по заболеваемости лидировал Приволжский федеральный округ. Лидером эпидемического процесса в этот год был новый по сравнению с сезоном 2008/2009 гг. вариант вируса гриппа А(H3N2).
Как уже указывалось, наиболее важным показателем тяжести пандемий гриппа является смертность [2].
 Особый интерес представляет возрастная структура смертельных исходов от пандемического гриппа. По сравнению с пандемией 2009 г. за последующие 3 эпидемии в возрастной структуре умерших в среднем увеличилась доля лиц старше 65 лет (с 2,4 до 8,9%) и детей 0–2 лет (с 1,4 до 2,7%), но уменьшилась доля лиц в возрасте от 18 лет до 31 года (с 27,2 до 17,0%). Среди умерших преобладали лица в возрасте от 42 до 53 лет как в эпидемию 2009 г. (28,7%), так и в последующие эпидемии (в среднем 29,5%). Эти показатели в значительной мере соответствуют международным данным [2, 4–9].
Особый интерес представляет возрастная структура смертельных исходов от пандемического гриппа. По сравнению с пандемией 2009 г. за последующие 3 эпидемии в возрастной структуре умерших в среднем увеличилась доля лиц старше 65 лет (с 2,4 до 8,9%) и детей 0–2 лет (с 1,4 до 2,7%), но уменьшилась доля лиц в возрасте от 18 лет до 31 года (с 27,2 до 17,0%). Среди умерших преобладали лица в возрасте от 42 до 53 лет как в эпидемию 2009 г. (28,7%), так и в последующие эпидемии (в среднем 29,5%). Эти показатели в значительной мере соответствуют международным данным [2, 4–9].
По сравнению с эпидемией 2009 г. в последующие циклы пандемии среди умерших увеличилась доля лиц с хронической патологией, прежде всего с метаболическим синдромом, в том числе с диабетом и ожирением (от 31,8 до 36,0%) и сердечно-сосудистой патологией (от 18,9 до 36,0%).
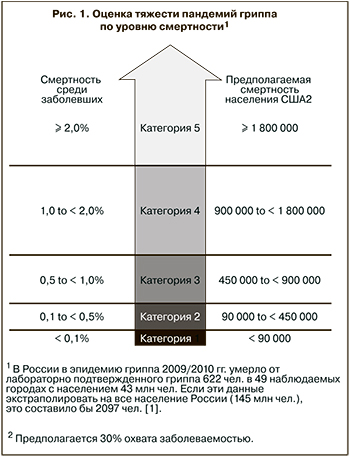
На рис. 1 представлена шкала оценки тяжести пандемий гриппа, предложенная на основании анализа пандемий ХХ столетия и принятая большинством экспертов ВОЗ [2].
Достоверный анализ смертности от гриппа представляет собой достаточно сложную задачу и зависит от принятой системы регистрации смертности, которая сильно различается в США, Европе и Российской Федерации. Совершенствование этой системы соответствует интересам здравоохранения и медицинского сообщества, так как должно быть основой повышения готовности страны к масштабным пандемиям гриппа. Важнейшим показателем тяжести пандемии является также дополнительная смертность, то есть смертность, обусловленная обострениями хронических соматических заболеваний после перенесенного гриппа. Дополнительная смертность среди населения Санкт-Петербурга в период пандемии 2009/2011 гг. составила 52,3 случаев на 100 тыс. населения. Если этот показатель экстраполировать на все население РФ (145 млн. чел.), то получится, что в этот период дополнительно умерли от соматических и инфекционных заболеваний 75 35 чел., то есть всего вместе с умершими от лабораторно подтвержденного гриппа это составило около 77 932 чел. Таким образом, пандемию в России, как и в США, можно отнести к 1-й категории по шкале оценки тяжести CDC [2–4].
Прошедшая пандемия существенно отличалась от пандемий ХХ столетия, при этом самой важной оценкой этой пандемии явилось объективное определение ее тяжести. На рис. 1 представлена оценка тяжести пандемии 2009/2011 гг. [2]. Объективная глобальная оценка тяжести прошедшей пандемии представляет особый интерес с точки зрения определения отношения между патогенностью и трансмиссивностью вируса и восприимчивостью к инфекции отдельных групп населения, а с другой стороны – с точки зрения эффективности эпидемиологических мероприятий и оказания помощи больным с осложненным гриппом. Прошедшая пандемия гриппа по степени тяжести может быть отнесена к умеренным. Вместе с тем такая оценка в сравнении с пандемиями прошлого столетия не дает реальной картины, так как в этот период проводилась активная вакцинация населения, и доступны были высокоэффективные противовирусные препараты.
В этот период активизировались научные исследования, результаты которых позволяют в определенной степени пересмотреть ряд традиционных представлений об эпидемиологии гриппа и оценить эффективность терапии осложненного гриппа и гриппозной инфекции среди групп риска, включающих пациентов с различными видами хронической инфекционной и соматической патологии [3].
Итогам пандемии гриппа, вызванной вирусом А(H1N1)pdm09, посвящен ряд фундаментальных статей [4–7, 10]. Особое внимание было обращено на патогенность вирусов гриппа А(H1N1)pdm09 и фатальные осложнения у беременных женщин [2, 8–14].
Анализ результатов пандемии 2009/2011 гг. показал, что ряд наблюдений и открытий могут иметь серьезное значение для углубления представлений о клинике и патогенезе современного гриппа и значении реакций врожденного и приобретенного иммунного ответа для течения заболевания [8–13].
На рис. 2 (см. на вклейке) представлена карта мира с наложением соотношения смертности от гриппа А(H1N1)pdm09 на 1 млн человек и частоты HLA-A*24 аллеей в популяциях 34 стран мира [8]. Для анализа использовались данные, доступные в источниках по общественному здоровью и медицинской литературе [8–13]. Представлен сравнительный картографический анализ частоты HLA-аллелей и смертности от гриппа А(H1N1)pdm09 в различных популяциях населения. Несмотря на наличие данных по картированию HLA на территории бывшего СССР и России [14], на рисунке Россия представлена «белым пятном» в связи с отсутствием такого анализа.
Исследования презентации антигенов 52 вирусов гриппа человека различными аллелями HLA показали, что связывание вирусных антигенов с HLA преимущественно ограничено консервативными детерминантами вирусного протеома [8]. При этом известно, что эффективность взаимодействия, например, антигенов вируса ВИЧ-1 с HLA прямо коррелирует с течением заболевания: низкое сродство эпитопов к определенным аллелям HLA связано с прогрессированием заболевания, высокая аффинность – с благоприятным течением. Опыт анализа связи между HLA, иммунным ответом на ВИЧ-инфекцию и течением заболевания авторами использован для глобального анализа чувствительности популяций населения различных регионов Земли к гриппозной инфекции с ориентацией на Т-клеточный иммунный ответ [8].
Результаты изучения роли HLA в реакции на гриппозную инфекцию свидетельствуют о том, что основные типы HLA распознают консервативные области вирусных белков, что является основой выработки протективного иммунитета и приводит к элиминации вируса из организма. При этом в пределах отдельных популяций с высокой частотой определенных аллелей HLA отчетливо проявляются признаки повышенной чувствительности к гриппу, особенно в условиях пандемий [8]. Проведенный компьютерный анализ связи HLA и географического распределения популяций с различными гаплотипами HLA свидетельствует о том, что сродство консервативных эпитопов к тем или иным подтипам HLA является базовым показателем заболеваемости гриппом в отдельных регионах планеты [8, 14]. Более того, выявлена корреляция с тяжестью течения гриппозной инфекции и HLA-аллелями. Более глубокий анализ смертности от гриппа и популяционного профиля HLA в расовых/этнических группах населения выявил необычайно высокое преобладание аллелей A*24 и высокую частоту госпитализаций в палаты интенсивной терапии, а также смертельных исходов от гриппа А(H1N1)pdm09. Близкие данные получены также для фенотипа A*68:01, широко распространенного среди коренного населения Северной Америки [8]. Авторы исследования считают, что использование данных по геногеографии HLA-аллелей в региональных популяциях может составлять объективную основу для оценки рисков заболеваемости и исходов гриппа, включая потенциальный ущерб от эпидемий гриппа.
В исследовании S.A. Webb с соавт. [11] продемонстрирована преобладающая частота случаев осложненного течения гриппа среди местного населения Австралии и Новой Зеландии, характеризующегося высокой частотой носительства аллеля HLA A*24. Смертность от гриппа в этой популяции в 2009 г. была в 3–8 раз выше по сравнению с остальной частью населения [11].
Экстраполяция данного подхода на пандемию 1918/1919 гг. показала, что смертность среди местного населения (индейцев США) от гриппа H1N1 была существенно выше: 8,5 и 2,5% соответственно, то есть от 3 до 8 раз. Эпидемия «азиатского гриппа» 1957 г. на Дальнем Востоке СССР среди коренного населения также отличалась особой тяжестью и высокой смертностью.
Для территории Российской Федерации проведено картирование распределения населения и этнических групп по типам HLA [14]. Результаты картографического анализа HLA на обширной территории России систематизированы в обширном издании АН СССР [15]. Поэтому использование этой базы в системе надзора за гриппом позволит выделить наиболее чувствительные к вирусам гриппа популяции и составить основу целевого конструирования и использования противогриппозных вакцин.
Кроме преморбидного фона, особенностей реакции на вирусную инфекцию в соответствии с особенностями гаплотипа HLA, согласно результатам исследований последних 4 лет, особое значение имеет распространенность мутаций, повышающих чувствительность к заражению гриппом и предрасполагающих к тяжелому течению этой инфекции [16–23]. Отсутствие таких данных затрудняет прогнозирование заболеваемости инфекционными и соматическими болезнями и их влияния на наиболее важные демографические показатели. Кроме этого, совершенно очевидно, что необходимо изменить критерии оценки эффективности противогриппозных вакцин и проводить их анализ с ориентацией на генетическую разнородность популяций людей, населяющих Российскую Федерацию, в соответствии с мировой практикой [16, 24–25].


