Болезнь кошачьей царапины (БКЦ) – cat scratch disease (CSD) – за последние 20 лет выявляют во многих странах мира. Это доброкачественный лимфоретикулез, вызываемый Bartonella henselae. Заболевание мало известно в России.
Цель представленной работы – привлечь внимание врачей-инфекционистов, эпидемиологов, педиатров к БКЦ.
БКЦ впервые описана в 1950 г. у больного в Париже как лимфоаденопатия с образованием эритематозныx папул или пустул в местах инокуляции, сохраняющихся несколько месяцев. Этиология болезни была неизвестна [1]. Некоторые исследователи приписывали её Aphipia felis, но в дальнейшем ДНК этого микроорганизма у больных не обнаружена.
В 1992 г. возбудитель заболевания – Bartonella henselae – был выделен из крови больного, в сыворотке которого присутствовали антитела к вирусу иммунодефицита человека (ВИЧ) [2].
В последующие годы после выделения возбудителя и разработки методов лабораторной диагностики происходило выявление болезни в США, Франции, Англии, Испании, Португалии, Германии, Греции, Италии, Нидерландах, Польше, Словении, Израиле, КНР, Таиланде, Южной Африке, Шри Ланке, Бразилии. Этот список ежегодно пополняется.
Этиология. Возбудитель БКЦ – Bartonella (Rochalimaea) henselae [названа в честь Дианы Хенсель (D. Hensel), американского микробиолога, принимавшей активное участие в его изучении] – входит в семейство Bartonellaceae альфа-2 подгруппы протеобактерий, образованного после объединения Bartonella и риккетсий рода Rochalimaea [3].
B. henselae – мелкая бактерия палочковидной формы с факультативном внутриклеточным паразитизмом, растёт как на плотных питательных средах с добавлением эритроцитов, так и в культуре клеток при температуре 34 °С в присутствии СО2. Многие исследователи отмечают трудность её культивирования: нестабильное накопление, медленный (до 15 сут) рост на плотных средах. Однако при пассажах свежих колоний B. henselae их рост в клеточных культурах наблюдается уже через 4 дня.
Размер B. henselae – 1–2 мкм в длину и 0,5 мкм в ширину, грамотрицательна, окрашивается по методу Гименьеса. Колонии B. henselae на плотной среде напоминают цветную капусту. Рост колоний на агаре продолжается до нескольких недель. При последующих пассажах образуются гладкие колонии, которые не внедряются глубоко в агар, как у других членов рода.
Как новый вид B. henselae отличается по секвенированию 16S rRNA [4, 5]. Для внутривидовой идентификации бартонелл, в частности для субтипирования B. henselae, используют ген цитратсинтазы gltA; ген белка теплового шока groEL; ген htrA, кодирующий белок 17 кДa; ген белка клеточного деления ftsZ, в частности его С-терминального региона, имеющего более выраженную степень дивергенции сиквенсов. Ген р26 белка B. henselae, являющегося иммунодоминантным антигеном, считается потенциальным маркером для идентификации и генотипирования бартонеллезных видов. Ген р26 кодирует образование двух белков 26 и 27,5 кДа, которые реагируют с антителами к B. henselae. Праймеры для амплификации данного гена были получены у 4 штаммов B. henselae.
Эпидемиология. Заболевания БКЦ, по данным зарубежных источников, чаще наблюдают осенью и зимой. Наблюдения, проведенные во Франции в 1999–2009 гг. показали, что большинство (87,5%) случаев отмечено с сентября по апрель с пиком в декабре, что совпадает с пребыванием кошек в доме [6]. Болеют, главным образом, дети и молодые люди, а также взрослые с явлениями выраженного иммунодефицита. Можно предположить, что в группу риска входят также ветеринары и бездомные. Так, в 7,1 и 51,1% сывороток крови ветеринаров в Европе и США имелись антитела к B. henselae, выявляемые путем реакции непрямой иммунофлуоресценции (РНИФ) [7]. В результате изучения наличия бартонелл у бездомных в Токио методом полимеразной цепной реакции (ПЦР) 10 из 150 проб крови были положительными с ISR-праймерами (16S) 23S rRNA. В США ежегодно госпитализируют более 24 тыс. человек. Количество сероположительных лиц среди здорового населения колеблется от 4 до 6%.
Источник и переносчик B. henselae – инфицированная домашняя кошка, в слюне которой присутствует возбудитель. Впервые на роль кошек в качестве резервуара B. henselae указали J.E. Koehler и соавт. [8]. Во время «умывания» слюна, содержащая бартонеллы, попадает в углубления под коготком [9, 10]. Царапины или укус кошки служит входными воротами инфекции. Вовлечение кошек в жизненный цикл B. henselae подтверждается выделением микроорганизма у половины исследованных кошек во Франции. Отмечено, что кошки, из крови и лимфоузлов которых выделяют B. henselae, остаются внешне здоровыми. Иногда у кошек с бактериемией нет антител. Бактериемия у кошек длительная, на протяжении нескольких месяцев. Трансплацентарная и перинатальная передача не отмечена. Заражение кошек друг от друга происходит через кожу. Доказано, что внутрикожное заражение более эффективно, чем внутривенное введение B. henselae. Установлена экспериментальная передача инфекции среди кошек блохами. Серологические исследования кошек показали, что антитела находят у 40–70% животных, и процент возрастает в районах с тропическим климатом, где также отмечена высокая численность блох.
При обследовании домашних кошек в США установлено, что серопозитивность варьирует от 3,7 до 54,6%. В высокогорных районах Скалистых гор (США) серопозитивность была меньше – 10%. Вместе с тем в этих же районах найден более высокий процент серопозитивных диких кошек. Наличие антител к B. henselae на Гавайях у кошек равнялось 47%, в Японии – 15%, Индонезии – 54%, Израиле – 40%, Египте – 11%, Португалии – 7%, Сингапуре – 48%, Южной Африке – 21%, Зимбабве – 21%. Преобладал титр 1:64 в РНИФ [7]. Бoльшая часть кошек переносит БКЦ бессимптомно [11]. Интересны исследования кошек, инфицированных вирусом кошачьего иммунодефицита. В опыте на 170 животных выявлено, что ко-инфекция B. henselae и вируса кошачьего иммунодефицита приводит к утяжелению клинических симптомов. Обнаружена строгая специфичность B. henselae по отношению к домашним животным. Собаки не заражаются БКЦ, а кошки невосприимчивы к B. vinsonii, распространенной среди собак [8].
Переносчиком B. henselae могут быть также блохи кошек – Ctenocephalides felis, у которых бартонелла передается трансмиссивно [12]. Возможно заражение людей в результате попадания на кожу фекалий инфицированных блох [13]. Роль иксодовых клещей дискуссионна [11]. Так, описаны случаи БКЦ после присасывания искодовых клещей. ДНК B. Henselae выявлена у Ixodes ricinus на Северо-Востоке США, в Северной Европе [14] и в Италии [15].
Клиническая картина. Инкубационный период длится от 3 до 20 дней. На месте поврежденной кожи развивается первичный аффект в виде папулы или пустулы у 25–60 % больных. Кожные повреждения развиваются в течение 3–10 дней до появления лимфаденопатии, а последняя развивается через 1–2 нед после заражения. Для БКЦ характерна лихорадка разной интенсивности и продолжительности. Иногда субфебрильная температура держится неделями у пациентов с неподтвержденным диагнозом и не получавших этиотропную терапию. Как правило, клинические проявления вариабельны. У 50% больных невысокая лихорадка и недомогание сопровождают лимфаденопатию. Развивается головная боль, анорексия, потеря веса, тошнота, рвота, может наблюдаться неспецифическая макулопапулезная сыпь, узловатые эритемы, спленомегалия и поражение нервной системы [5, 9, 10]. У 1–2% детей и подростков с атипичной БКЦ наблюдают нейроретинит с временной потерей зрения [16].
Описаны рецидивы болезни у леченных больных. У больных с иммунодефицитом частыми симптомами являются бациллярный ангиоматоз и пелиозный гепатит [1, 2, 5, 9, 17]. У нелеченных больных продолжительность заболевания составляет 6–12 нед.
Приводим описание первого случая БКЦ у больного, из крови которого был выделен новый вид бартонелл – Bartonella henselae [18].
ВИЧ-положительный мужчина 40 лет, поступил в госпиталь после 2-месячной ежедневной лихорадки, выраженной астенизации, анорексии и потери 10 кг веса. В эпиданамнезе – 4-месячное путешествие, во время которого были контакты с кошками, хорьками, собаками; указания на укусы или царапины отсутствуют. При поступлении: температура тела 39,4 °С, ЧСС – 95 в минуту, АД 90/46. При физикальном обследовании выявлены молочница, голосистолические шумы и перианальные язвы. Лейкоциты – 4,9×109/л (из них 80% – сегментоядерные, 11% – лимфоциты, 4% – моноциты, 4% – эозинофиллы, 1% – базофиллы). Остальные лабораторные показатели в пределах нормы. Рентгенография грудной клетки выявила расширение средостения. Эхокардиография выявила утолщение аортальных клапанов. Абдоминальная компьютерная томография выявила гепатоспленомегалию. Результаты исследования других органов и спинномозговой жидкости были в пределах нормы.
Лихорадочная реакция (38–40 °С) продолжалась у больного в течение 5 нед. После поступления в госпиталь образцы крови, взятые в 1-й и на 8-й день пребывания в стационаре, в посевах на BHI агар с 5% крови овцы, на tryptic soy агар с 5 % крови овцы и на heart infusion агар с 5% крови кролика дали положительные результаты на микроорганизмы Rochalimaea-like, позднее описанные как новый вид Bartonella henselae. С предположительным диагнозом «траншейная лихорадка» пациенту был назначен 2-дневный курс доксициклина ( по 100 мг 2 раза в день). Через 48 ч у больного отмечена положительная динамика. Через 6 мес после прекращения терапии лихорадка, анорексия и недомогания вернулись. Кровяные культуры, взятые в это время, опять были положительные на микроорганизмы Rochalimaea-like. После второго рецидива лихорадки назначен 2-месячный курс доксициклина. Повторные гемокультуры, взятые в последующие 6 мес, были негативными и симптомы болезни не повторялись.
Диагностика. В первые годы изучения БКЦ диагностику осуществляли по клиническим симптомам и и результатам исследования биоптатов кожи из мест повреждения в световом микроскопе. Позднее стали выявлять ДНК B. henselae при помощи ПЦР c применением бартонеллезных межгенных спейсерных праймеров 16S/23SL rRNA (ISR-праймеры). Данные праймеры обладают высокой видоспецифичностью и служат индикатором межвидовых различий у разных видов бартонелл. Применение метода ПЦР с ISR-праймерами и последующим секвенированием имеет ряд преимуществ: 1) не требуется выделение возбудителя; 2) нужны малые объемы крови; 3) нет необходимости работать в стерильных условиях. Распространена серодиагностика с помощью иммуноферментного метода. По мнению большинства врачей, наиболее предпочтительна постановка РНИФ. Впервые эту реакцию применили R.L. Regnery и соавт. [18] в 1992 г. в США. Они показали, что из 41 сыворотки положительно реагировали 36 (88%) в титре 1:64. Этот титр характерен для большинства случаев болезни. Чувствительность РНИФ повышается с использованием антигена B. henselae, выращенных в клеточных культурах.
Как показали дальнейшие исследования, У 5–15% больных с типичной клинической картиной антитела не обнаруживаются. В то же время, антитела выявляют не только у больных, но и у части доноров крови, что объясняют субклинической инфекцией у владельцев кошек.
Возможен серологический перекрест с Coxiella burnetii, наблюдаемый у больных с хронической формой коксиеллеза – эндокрадитом. Исследовано 288 сывороток крови в РНИФ с антигенами C. burnetii, B. henselae, B. quintana, а также 77 сывороток больных БКЦ, исследованных с антигеном C. burnetii. Показано, что более чем 50% сывороток с хроническим коксиеллезом реагировали с B. henselae в значительных титрах. После иммунoсорбции титр антител у больных БКЦ с симптомами эндокардита был выше. Сделан вывод, что наличие высокого титра антител к B. henselae в присутствии антител к C. burnetii в низких титрах свидетельствует о заболевании БКЦ [19].
Лечение. В качестве терапии рекомендован азитромицин по 0,25 г 1 раз в сутки в течение 5 дней. Альтернативная терапия осуществляется эритромицином (по 500 мг 4 раза в сутки), доксициклином (по 100 мг 2 раза в сутки) и рифампицином (по 0,3 г 2 раза в сутки) в течение 10–12 дней.
Препараты выбора – тетрациклин, кларитромицин, хлорамфеникол, офлоксацин, ципрофлоксацин, кетолид [20].
БКЦ в России можно отнести к малоизвестным инфекциям. Серологическая диагностика БКЦ проводится Центром по риккетсиозам РФ (НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи Минздрава России) с 1998 г. [21].
В Москве изучено 255 историй болезни пациентов с подозрением на БКЦ из Тушинской детской городской больницы, Морозовской детской городской клинической больницы, Инфекционной клинической больницы № 1.
Нами исследовано 373 сыворотки от больных с диагнозом «бартонеллез» или с подозрением на бартонеллез методом РНИФ с антигенами B. henselae (штаммы Houston-1 и Marseille). Антигены из штамма Houston-1 приготовлены в лаборатории экологии риккетсий, штамм Marsеille был любезно предоставлен проф. D. Raoult из Центра ВОЗ по риккетсиозам (Марсель, Франция), за что авторы выражают благодарность.
Представляют интерес результаты обследования больных из Гематологического научного центра РАМН. При исследовании 35 сывороток, отобранных по эпидемиологическим и клиническим показателям и с длительной лимфоденопатией, методом иммунофлуоресценции с двумя антигенами B. henselae(штаммы Houston-1 и Marseille) и ПЦР с последующим секвенированием были получены положительные результаты у 10 (4,6%) пациентов [22].
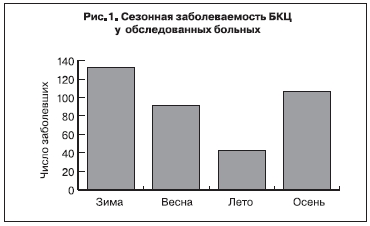
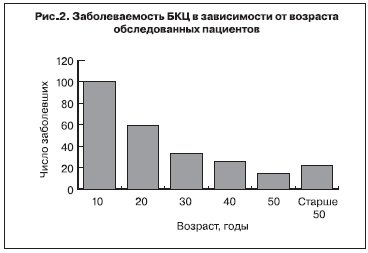
Заболеваемость БКЦ в Москве регистрируют преимущественно в зимний и осенний периоды (рис. 1). Установлено, что болеют люди всех возрастов, но основной контингент заболевших составляют лица до 20 лет (рис. 2). Контакт с кошками из 255 заболевших отметили 138 человек, что составляет 54,12%.
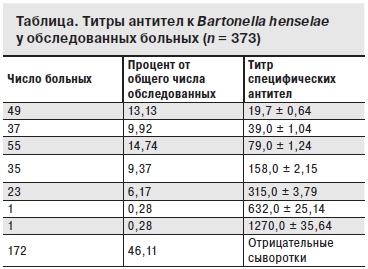
При исследовании сывороток крови методом РНИФ с антигенами Bartonella hehselae было установлено, что из 373 больных только у 201 (53,89%) пациента обнаружены специфические антитела к Bartonella henselae, 172 сыворотки крови были серонегативны (см. таблицу).
У 255 пациентов заболевание протекало с типичной симптоматикой разной степени тяжести (легкой, средней и тяжелой), у остальных 118 – в атипичной форме. Приводим примеры историй болезней пациентов с клинически поставленным диагнозом БКЦ, подтвержденным серологическим методом РНИФ.
Случай 1. Дима П., 10 лет. Выписка из истории болезни Тушинской детской городской больницы № 4116, куда ребенок был переведен из Московского областного клинико-диагностического центра (МОКДЦ) на 32-й день болезни с направляющим диагнозом «Субсепсис, множественные абсцессы печени и селезенки». Из анамнеза известно, что заболевание началось 07.01.12 подостро с появления увеличенных болезненных шейных и затылочных лимфоузлов, общей слабости, выраженной бледности, периодических болей в правом боку. На 3-й день болезни присоединилась фебрильная лихорадка (до 40 °С). Проведено лечение вильпрафеном, на фоне которого нормализовалась температура, однако сохранялись периодические боли в правом боку, появился herpes labialis. Общий анализ крови от 16.01.12: лейкоцитоз 30х109 г/л нейтрофильного характера со сдвигом формулы влево, ускоренная СОЭ – 56 мм/ч. Из эпидемиологического анамнеза известно, что ребенок проживает в частном доме, имеется контакт с кошкой. Через 26 дней от начала заболевания вновь отмечается повышение температуры тела до 38 °С, ребенок направлен для уточнения диагноза в МОКДЦ, где при УЗИ брюшной полости выявлены очаговые изменения в печени и селезенке. С подозрением на абсцесс печени и селезенки направлен в хирургическое отделение Тушинской детской городской больницы № 4116. В ходе обследования данные за абсцесс печени и селезенки не подтвердились. 15.02.12 больной переведен в инфекционное отделение этой же больницы, где было проведено многоплановое обследование. При поступлении температура 37,1 °С, кожные покровы чистые, видимые слизистые оболочки бледно-розового цвета, имеются явления ангулярного стоматита. Периферические лимфоузлы подвижные, эластичные, безболезненные, не спаянные с кожей, шейные увеличены до 6 мм. Костно-мышечная система, легкие и сердце без патологии. Живот мягкий, безболезненный, пальпируется увеличенная печень +1,5 см, край её эластичный, безболезненный. Селезенка не пальпируется. В общем анализе крови выявлен умеренный лейкоцитоз с увеличением количества сегментоядерных лейкоцитов и ускоренная СОЭ – 50–55 мм/ч. Биохимические показатели в пределах нормы. Посев на стерильность: роста нет. При проведении реакции пассивной гемагглютинации (РПГА) на сальмонеллез, дизентерию, псевдотуберкулез получены отрицательные результаты. При иммуноферментном анализе (ИФА) в сыворотке крови обнаружены специфические IgG и IgM к вирусу герпеса 1-го и 2-го типов, превышающие норму соответственно в 9,95 и 2 раза. Отмечено повышение уровня ЦМВ IgG в 5,3 раза. При определении методом ИФА IgG и IgM с микоплазмами пневмонии выявлено превышение нормы IgG в 1,59раза, а IgM – в 5 раз. При исследовании на хламидиоз установлено, что IgG к хламидиям пневмонии превышают норму в 6,64 раза, к IgM – в 4 раза, выявлены IgМ к Clamydia trachomatis в титре 1:10. Методом ИФА выявлены IgG к антигену токсокар в титре 1:400. Обнаружено повышение IgG к ядерному антигену вируса Эпштейна–Барр в 21,2 раза.
При исследовании сыворотки крови методом РНИФ с B. henselae выявлены антитела в титре 1:40, с антигеном C. burnetii получен отрицательный результат.
При повторном УЗИ отмечено увеличение печени до 120 мм, край острый, I сегмент до 30% от размера левой доли, паренхима пониженной эхогенности, во всех сегментах большое количество гипоэхогенных включений с размытыми контурами размерами до 10–13 мм, усиление сосудистого рисунка, в воротах печени большое количество лимфоузлов до 2 см. Селезенка не увеличена, но определяются мелкие гипоэхогенные включения, единичные до 5 мм в диаметре). В почках патологии не выявлено. При УЗИ шеи выявлено, что околоушные и подчелюстные железы неоднородны, множественные лимфоузлы шеи до 6 мм овальной формы. ЭКГ в пределах возрастной нормы.
Спиральная компьютерная томография (СКТ) органов грудной клетки: бронхоаденопатия с единичной петрификацией лимфоузлов. В брюшной полости, забрюшинном пространстве при внутривенном контрастировании (Ультравист 300) выявлено очаговое поражение печени и селезенки, вероятно, сосудистого характера (ангиоматоз).
Полученные положительные результаты обследования на бартонеллез позволили поставить клинический диагноз: «Бартонеллезная инфекция («болезнь кошачьей царапины»), генерализованная форма. Бациллярный ангиоматоз, хронический. Персистирующая герпесвирусная инфекция, обострение».
Лечение: последовательная смена курсов (по 7 дней) антибактериальных препаратов –цефсон, ципрофлоксацин, кларитромицин; кроме того, альбендазол, фурагин, нистатин, бифиформ, виферон, суппозитории.
При обследовании ребенка в динамике через 2 мес при УЗИ изменения в паренхиме печени не выявлено.
Случай 2. Павел В., 7 лет. Выписка из истории болезни № 06428 Морозовской детской городской клинической больницы (МДГКБ).
05.05.12 ребенка поцарапала домашняя кошка с латеральной стороны левой голени. Развитие симптомов болезни происходило постепенно, начиная с 3-го дня после контакта с кошкой. Начиная c 08.05. 12 в области царапин появилась гиперемия размером 5,0 х 4,0 см, со светлым центром, отмечалось местное повышение температуры, боль в области царапины. Проведено лечение левомеколем, мазью на область раны. В хирургическом отделении МДГКБ проведена противостолбнячная терапия: АИГ + КОКАВ + АС. 11.05.12 в домашних условиях, несмотря на проведенное лечение левомеколем, супрастином, кожные проявления нарастали: область гиперемии увеличивалась, голень горячая на ощупь. Температура тела все дни была в норме. 11.05 был направлен в кожно-венерологический диспансер по месту жительства (зоонозная инфекция?). Заключение: аллергическая реакция, в плане лечения продолжить антигистаминную терапию + аппликация глюкокортикостероидной мазью. Лечение было неэффективно. Симптомы болезни нарастали 12.05. – левая голень отечна, горячая на ощупь, яркая гиперемия распространилась от голеностопного до коленного сустава, появились боли в области паховых лимфоузлов, локтевых, кистевых суставов (боли двусторонние, но больше слева). Проконсультирован дерматологом и хирургом. Ребенок госпитализирован в МДГКБ 12.05.12. При поступлении состояние средней тяжести. Температура 36,0 °С. Кожные покровы бледно-розовые, без инфекционной сыпи. В области левой голени на латеральной поверхности участок гиперемии размером 25,0 х 7,0 см, бледный по центру, при пальпации плотный, болезненный, в центре ссадина под корочкой. Слизистая оболочка ротоглотки чистая. Отмечается увеличение лимфатических узлов разных анатомических областей: подчелюстные, шейные – мелкие, эластичны, подвижны; паховые лимфоузлы справа парные, плотные, до 1,5 см, болезненные. Болезненность в области локтевых, кистевых суставов. Носовое дыхание не затруднено. В легких дыхание везикулярное, хрипов нет. Тоны сердца громкие, ритмичные. Живот мягкий, безболезненный при пальпации. Печень, селезенка не увеличены. Стул оформленный. Мочеиспускание не нарушено. Менингеальных симптомов нет. Показатели общего анализа крови без особенностей: лейкоциты – 9,9 х 109/л, СОЭ – 11 мм/час. Биохимический анализ без особенностей. Иммунологический статус в пределах нормы. Титр специфических антител к B. henselae 1:160. Осмотр хирурга от 12.05.12: данных за острое хирургическое заболевание нет. Осмотр ЛОР-врача от 17.05.12: данных за острую ЛОР-патологию нет. 18.05.12 проведена консультация профессора кафедры детских инфекционных болезней № 1 Ф.С. Харламовой и поставлен диагноз: «Бартонеллез».
Лечение: с 12.05 по 18.05 –макропен 400 мг 3 раза в сутки, фенкарол 5 мг 2 раза в сутки, повязка с 50% С2Н5ОН. С 18.05 по 22.05 –юнидокс ½ таблетки х 2 раза в сутки per os, тавегил ½ таблетки х 2 раза в сутки per os.
Случай 3. Даша Ш., 14 лет. Выписка из истории болезни № 10006 (Инфекционная клиническая больница № 1). Из клинических проявлений отмечала лихорадку в течение 20 дней, сыпь, увеличение шейных лимфоузлов, увеличение печени и селезенки. При серологическом исследовании методом РНИФ титр специфических антител к Bartonella henselae составил 1:80, с антигеном B. quintana – 1:80, с антигеном С. burnetii получены отрицательные результаты. При повторном исследовании сыворотки крови на 12-й день болезни титры специфических антител не изменились. Диагноз: «Бартонеллез».
Таким образом, БКЦ известна во многих странах мира. В России этой инфекции уделяется недостаточное внимание, тогда как она имеет широкое распространение и причиняет ущерб здоровью главным образом детей. Как очевидно из приведенных историй болезней, необходимо уделять внимание эпиданамнезу, что приведет к верной клинической диагностике, обязательно подтвержденной серологическими, иммунологическими и генотипическими исследованиями, и в результате – к этиотропной терапии.


